
【题目】一定温度下,恒容密闭容器中发生N2(g)+3H2(g)![]() 2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
2NH3(g)反应,反应速率与反应时间的关系如图所示。对两种平衡状态下各物理量的比较错误的是( )
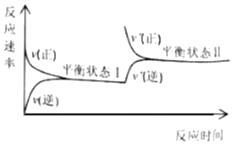
A.平衡状态Ⅱ时的c(H2)一定小B.平衡状态Ⅱ时的c(NH3)一定大
C.平衡常数K一样大D.平衡状态Ⅱ时的v(正)一定大
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。以废铁屑(含有少量Ni)为主要原料制备高铁酸钾的流程如下:
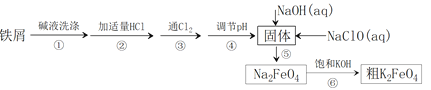
资料显示:一些金属氢氧化物开始沉淀和完全沉淀的pH如下:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)高铁酸钾具有高效消毒主要是因其具有__________性所致。
(2)步骤③反应的离子方程式是_______。
(3)步骤④不能引入新杂质,调节pH所用的某种氧化物的化学式是___________,调节pH的范围是__________________。
(4)步骤⑤发生反应的离子方程式是________。
(5)该流程中可循环利用的物质是:_______(写化学式)。
(6)步骤⑥中,由Na2FeO4 得到粗K2FeO4的原理可能是___________。
(7)测定产品纯度:将wg粗产品,溶入过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1 (NH4)2Fe(SO4)2溶液滴定至终点,消耗滴定液V mL。有关滴定反应有:
Cr(OH)4-+FeO42-+3H2O![]() Fe(OH)3·3H2O↓+CrO42- +OH
Fe(OH)3·3H2O↓+CrO42- +OH
2![]() +2H
+2H![]()
![]() +H2O
+H2O
![]() +6Fe2++14H
+6Fe2++14H![]() 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
该粗产品中K2FeO4的纯度为____________(用含w、c、V的代数式表示)。若滴定管没有用待装液润洗,则测得结果________(“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯是合成食品外包装材料聚乙烯的单体,可以由丁烷裂解制备。裂解的副反应为C4H10(g,正丁烷)![]() CH4(g)+C3H6(g),请回答下列问题:
CH4(g)+C3H6(g),请回答下列问题:
(1)化学上,将稳定单质的能量定为0,由元素的单质化合成单一化合物时的反应热叫该化合物的生成热,生成热可表示该物质相对能量。25 ℃、101 kPa几种有机物的生成热如下表所示:
物质 | 甲烷 | 乙烷 | 乙烯 | 丙烯 | 正丁烷 | 异丁烷 |
生成热/kJ· mol-1 | -75 | -85 | 52 | 20 | -125 | -132 |
由正丁烷裂解生成乙烯的热化学方程式为_____________________________。
(2)一定温度下,在恒容密闭容器中投入一定量正丁烷发生反应生成乙烯。
下列情况能说明该反应达到平衡状态的是________(填标号)。
A.气体密度保持不变 B.c(C2H4)·c(C2H6)/c(C4H10)保持不变
C.反应热保持不变 D.正丁烷分解速率和乙烷消耗速率相等
(3)向密闭容器中充入正丁烷,在一定条件(浓度、催化剂及压强等)下发生反应,测得乙烯产率与温度关系如图所示。温度高于600℃时,随着温度升高,乙烯产率降低,可能的原因是____________。
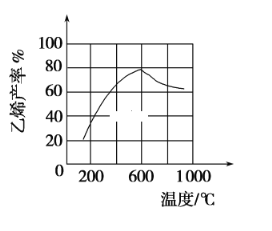
(4)在一定温度下向10 L恒容密闭容器中充入2 mol正丁烷,反应生成乙烯和乙烷,经过10 min达到平衡状态,测得平衡时气体压强是原来的1.75倍。
①0~10 min内乙烷的生成速率v(C2H6)=________ mol·L-1·min-1。
②上述条件下,正丁烷的平衡转化率为_______,该反应的平衡常数K为_____。
(5)丁烷空气燃料电池以熔融的K2CO3(其中不含O2-和HCO3-)为电解质,以具有催化作用和导电性能的稀土金属材料为电极。该燃料电池的正极反应式为26CO2+13O2+52e-===26CO32-,则负极反应式为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】液体燃料电池相比于气体燃料电池具有体积小等优点.一种以液态肼(N2H4)为燃料的电池装置如图所示,该电池用空气中的氧气作为氧化剂,KOH溶液作为电解质溶液.关于该电池的叙述正确的是( )

A. b极发生氧化反应
B. a极为该电池的正极
C. 放电时,电流从a极经过负载流向b极
D. a极的反应式:N2H4+4OH﹣﹣4e﹣═N2↑+4H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】第ⅤA族元素的原子R与A原子结合形成RA3气态分子,其立体结构呈三角锥形。RCl5在气态和液态时,分子结构如下图所示,下列关于RCl5分子的说法中正确的是( )
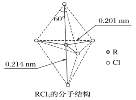
A. 每个原子都达到8电子稳定结构
B. 分子中5个R—Cl键键能不相同
C. 键角(Cl—R—Cl)有90°、120°、180°几种
D. RCl5受热后会分解生成分子RCl3,RCl5和RCl3都是极性分子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,1.06g Na2CO3含有的Na+离子数目为0.02 NA
B.常温常压下,2NA个CO2分子占有的体积为44.8L
C.标准状况下,22.4LH2O含有的分子数为 NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是Na、Cu、Si、H、C、N等元素单质的熔点高低顺序,其中c、d均是热和电的良导体。
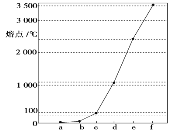
(1)请写出上图中e单质对应元素原子的电子排布式:________。
(2)a、b、f对应的元素以原子个数比1∶1∶1形成的分子中σ键和π键个数之比为___。
(3)图中d单质的晶体堆积方式类型是:____。
(4)a与b元素形成的10电子中性分子X的空间构型为_____;将X溶于水后的溶液滴入含d元素高价离子的溶液中至过量,生成的含d元素离子的化学式为___,其中X与d的高价离子之间以___键组合。
(5)下列是上述六种元素中的一种元素形成的含氧酸的结构:![]() ,请简要说明该物质易溶于水的原因:_____________。
,请简要说明该物质易溶于水的原因:_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室以空气和镁为原料制备 Mg3N2 的装置如图所示(夹持和加热装置略去):
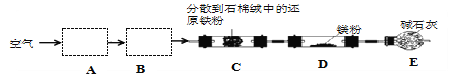
下列说法正确的是( )
A. 装置 A、B 中可依次加入浓硫酸、NaOH 溶液
B. 若去掉装置 C,对产品纯度无影响
C. 实验时应先加热 C,通入一段时间空气后再加热D
D. E 中碱石灰的作用是吸收尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国传统文化对人类文明贡献巨大,古代文献中记载了古代化学研究成果。下列常见古诗文对应的化学知识正确的是
常见古诗文记载 | 化学知识 | |
A | 《梦溪笔谈》中对宝剑的记载:“古人以剂钢为刃,柔铁为茎干,不尔则多断折” | 铁的合金硬度比纯铁的大,熔点比纯铁的高 |
B | 《本草纲目拾遗》中对强水的记载:“性最烈,能蚀五金,其水甚强,惟玻璃可盛” | 强水为氢氟酸 |
C | 《天工开物》中记载:凡火药,硫为纯阳,硝为纯阴 | 硫指的是硫黄.硝指的是硝酸钾 |
D | 《泉州府志》中记载:安南人黄姓者为宅煮糖,墙塌压糖,去土而糖白,后人遂效之 | 糖白的过程发生了化学变化 |
A. AB. BC. CD. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com