
����Ŀ����ϩ�Ǻϳ�ʳƷ���װ���Ͼ���ϩ�ĵ��壬�����ɶ����ѽ��Ʊ����ѽ�ĸ���ӦΪC4H10(g��������)![]() CH4(g)��C3H6(g)����ش��������⣺
CH4(g)��C3H6(g)����ش��������⣺
(1)��ѧ�ϣ����ȶ����ʵ�������Ϊ0����Ԫ�صĵ��ʻ��ϳɵ�һ������ʱ�ķ�Ӧ�Ƚиû�����������ȣ������ȿɱ�ʾ���������������25 �桢101 kPa�����л�������������±���ʾ��
���� | ���� | ���� | ��ϩ | ��ϩ | ������ | �춡�� |
������/kJ�� mol��1 | ��75 | ��85 | 52 | 20 | ��125 | ��132 |
���������ѽ�������ϩ���Ȼ�ѧ����ʽΪ_____________________________��
(2)һ���¶��£��ں����ܱ�������Ͷ��һ���������鷢����Ӧ������ϩ��
���������˵���÷�Ӧ�ﵽƽ��״̬����________(����)��
A�������ܶȱ��ֲ��� B��c(C2H4)��c(C2H6)/c(C4H10)���ֲ���
C����Ӧ�ȱ��ֲ��� D��������ֽ����ʺ����������������
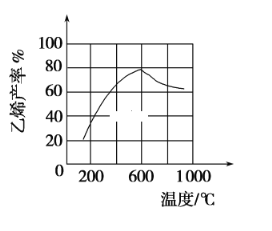
(3)���ܱ������г��������飬��һ������(Ũ�ȡ�������ѹǿ��)�·�����Ӧ�������ϩ�������¶ȹ�ϵ��ͼ��ʾ���¶ȸ���600��ʱ�������¶����ߣ���ϩ���ʽ��ͣ����ܵ�ԭ����____________��
(4)��һ���¶�����10 L�����ܱ������г���2 mol�����飬��Ӧ������ϩ�����飬����10 min�ﵽƽ��״̬�����ƽ��ʱ����ѹǿ��ԭ����1.75����
��0��10 min���������������v(C2H6)��________ mol��L��1��min��1��
�����������£��������ƽ��ת����Ϊ_______���÷�Ӧ��ƽ�ⳣ��KΪ_____��
(5)��������ȼ�ϵ�������ڵ�K2CO3(���в���O2����HCO3-)Ϊ����ʣ��Ծ��д����ú͵������ܵ�ϡ����������Ϊ�缫����ȼ�ϵ�ص�������ӦʽΪ26CO2��13O2��52e��===26CO32-������ӦʽΪ_________________________��
���𰸡�C4H10(g��������)![]() C2H4(g)��C2H6(g) ��H ����92kJ�� mol�� BD �������Խ��ͣ����������� 0.015 75% 0.45 C4H10��13CO32-��26e��===17CO2��5H2O
C2H4(g)��C2H6(g) ��H ����92kJ�� mol�� BD �������Խ��ͣ����������� 0.015 75% 0.45 C4H10��13CO32-��26e��===17CO2��5H2O
��������
��1����Ӧ����ʽ���ʱ�=�������������-��Ӧ��������ȣ�
��2�����淴Ӧ�ﵽƽ��״̬ʱ�����淴Ӧ������ȣ���Ӧ��ϵ�и����ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
��3�������������¶�Ӱ�죬�л���ѧ��Ӧ�и���Ӧ�϶ࣻ
��4�����º��������£������ѹǿ֮�ȵ��������ʵ���֮�ȣ�����10min�ﵽƽ��״̬�����ƽ��ʱ����ѹǿ��ԭ����1.75����˵��ƽ������������ʵ�����ԭ����1.75��������������ʵ���=2mol��1.75=3.5mol��
���ӵ����ʵ����൱�����ɵ�n��C2H4��=n��C2H6��=��3.5-2��mol=1.5mol��ʣ���n��C4H10��=��2-1.5��mol=0.5mol��ƽ��ʱc��C2H4��=c��C2H6��=![]() =0.15mol/L��c��C4H10��=
=0.15mol/L��c��C4H10��=![]() =0.05mol/L��
=0.05mol/L��
��0��10min���������������v��C2H6��=![]() ��
��
�����������£��������ƽ��ת����=![]() ��100%���÷�Ӧ��ƽ�ⳣ��K=
��100%���÷�Ӧ��ƽ�ⳣ��K=![]() ��
��
��5�������϶���ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ��
��1����Ӧ����ʽ���ʱ�=�������������-��Ӧ��������ȣ����Ը÷�Ӧ���ʱ�=��52-85+125��kJ/mol=+92kJ/mol���������Ȼ�ѧ����ʽΪC4H10��g�������飩C2H4��g��+C2H6��g����H=+92kJmol-1��
��2��A����Ӧǰ���������������䡢����������䣬�����ܶ�ʼ�ղ��䣬���ܸ����ܶ��ж�ƽ��״̬����A����B��c��C2H4��c��C2H6��/c��C4H10�����ֲ���ʱ�������ʵ����ʵ���Ũ�Ȳ��䣬˵���ﵽƽ��״̬����B��ȷ��C����Ӧ��������������ȣ����Ƿ�ﵽƽ��״̬�أ���C����D��������ֽ���������������������ȣ����淴Ӧ������ȣ���Ӧ�ﵽƽ��״̬����D��ȷ���ʴ�ΪBD��
��3�������������¶�Ӱ�죬�л���ѧ��Ӧ�и���Ӧ�϶࣬�����¶����ߣ���ϩ���ʽ��ͣ����ܵ�ԭ���Ǵ������Խ��ͣ����������ࣻ
��4�����º��������£������ѹǿ֮�ȵ��������ʵ���֮�ȣ�����10min�ﵽƽ��״̬�����ƽ��ʱ����ѹǿ��ԭ����1.75����˵��ƽ������������ʵ�����ԭ����1.75��������������ʵ���=2mol��1.75=3.5mol��
���ӵ����ʵ����൱�����ɵ�n��C2H6��=n��C2H4��=��3.5-2��mol=1.5mol��ʣ���n��C4H10��=��2-1.5��mol=0.5mol��ƽ��ʱc��C2H6��=c��C2H4��=![]() =0.15mol/L��c��C4H10��=
=0.15mol/L��c��C4H10��=![]() =0.05mol/L��
=0.05mol/L��
��0��10min���������������v��C2H6��=![]() =
=![]() mol/��Lmin��=0.015mol/��Lmin����
mol/��Lmin��=0.015mol/��Lmin����
�����������£��������ƽ��ת����=![]() ��100%=
��100%=![]() ��100%=75%���÷�Ӧ��ƽ�ⳣ��K=
��100%=75%���÷�Ӧ��ƽ�ⳣ��K=![]() =
=![]() =0.45��
=0.45��
��5�������϶���ʧ���Ӻ�̼������ӷ�Ӧ���ɶ�����̼��ˮ���缫��ӦʽΪC4H10+13CO32--26e--=17CO2+5H2O��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������ϩ��һ��ʳ�����ϣ���ṹ��ʽ��ͼ��ʾ���й�����ϩ�ķ�����ȷ����
![]()
A.һ�������£����ֱ���Է����ӳɡ�ȡ������������ԭ�ȷ�Ӧ
B.���Ͷ�����(![]() )��Ϊͬ���칹��
)��Ϊͬ���칹��
C.���ķ��������е�̼ԭ��һ����ͬһƽ����
D.����һ�ȴ�����6��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʵ���⣺
1-�������һ����Ҫ���л��ϳ��м��壬�е�Ϊ71�棬�ܶ�Ϊ1.36g��cm-3��ʵ�����Ʊ����� 1-��������Ҫ�������£�
���� 1�������� A �м��������ӡ�12g �������� 20mLˮ����ˮ��ȴ�»������� 28mlŨ H2SO4����ȴ�����£������¼��� 24gNaBr��
(��֪�� ��2NaBr+H2SO4(Ũ)![]() Na2SO4+2HBr��
Na2SO4+2HBr��
����������Ũ���Ṳ�Ȼ������ϩ���ѵȸ���Ʒ)
���� 2����ͼ��ʾ�ʵ��װ�ã��������ȣ�ֱ������״�����Ϊֹ��
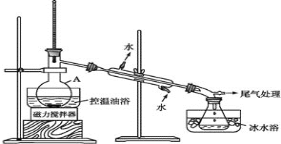
���� 3�������Һת���Һ©�����ֳ��л��ࡣ
���� 4�����ֳ����л���ת���Һ©���������� 12mLH2O��12ml5%Na2CO3 ��Һ��12mLH2O ϴ�ӣ���Һ���ôֲ�Ʒ����һ���ᴿ�� 1-����顣
(1)���� A ��������_____��
(2)��Ӧʱ���ɵ���Ҫ�л������� 2-������_______(���һ�ּ��ɸ���)
(3)���� 2 ���������ƿ�ڼ���������ˮ�����ڱ�ˮԡ�е�Ŀ����____��
(4)���� 1 ��Ũ H2SO4 ��ˮϡ�ͣ�����ȴ�����º��ټ� NaBr ��Ŀ����______������ 4 ���� Na2CO3 ��Һϴ�ӵ�Ŀ����_____��
(5)���� 4 �н�һ���ᴿ 1-�����ķ�����_________���ڽ��д˲���֮ǰ��Ҫ ����ˮMgBr2 �����ֲ�Ʒ����Ŀ����_____��
(6)1-�������һ��������Ҳ�����Ʊ� 1-����,��д���ɲ��� 1-������Ʊ� 1-�����Ļ�ѧ��Ӧ����ʽ________________________ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ϳɰ���ҵ�Թ��ú���ᷢչ������Ҫ�����塣�����ܱ������еķ�Ӧ��![]() ��
��![]() ��
��![]() ��
��![]() ��
��![]() ��ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������ȷ���ǣ� ��
��ʱ��仯�Ĺ�ϵ����ͼ��ʾ������������ȷ���ǣ� ��
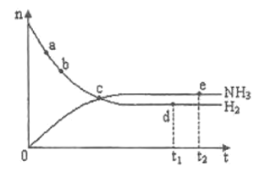
A.��a������Ӧ���ʱȵ�b�Ĵ�
B.��c����Ӧ�ﵽƽ��
C.��d��![]() ʱ�̣���
ʱ�̣���![]() ���ڵ�e��
���ڵ�e��![]() ʱ�̣���
ʱ�̣���![]()
D.�����������䣬![]() �·�Ӧ��
�·�Ӧ��![]() ʱ�̴ﵽƽ�⣬���ʱn(H2)����ͼ��d���ֵ��
ʱ�̴ﵽƽ�⣬���ʱn(H2)����ͼ��d���ֵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��ѧ��ȤС��Ϊ��̽���������CO2������Na2O2��Ӧ��������ʪ��CO2����Na2O2��Ӧ�������������װ�ý���ʵ��(�г�������ʡ��)��
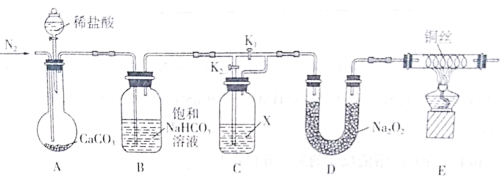
�ش��������⣺
(1)ʵ�鿪ʼǰ��ͨ��һ��ʱ���N2��Ŀ����________��
(2)����NaHCO3��Һ��������_________���Լ�X��___________��
(3)ʵ��ʱ�����ȴ�װ��A�з�Һ©���Ļ���������ϡ���Ȼ��ر�K1����K2��ʵ���й۲쵽E�����ȵ�ͭ˿��ɫδ�����仯����ó��Ľ�����_______��
(4)��_____(�����)��E�����ȵ�ͭ˿��Ϊ��ɫ����֤����ʪ��CO2����Na2O2��Ӧ��
(5)д��D��CO2��Na2O2��Ӧ�Ļ�ѧ����ʽ___________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������(M)��ҽҩ�����ϵ��м��壬ʵ�����ɷ��㻯����A�Ʊ�M��һ�ֺϳ�·�����£�
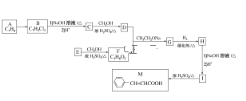
��֪����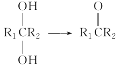 (R1��R2��ʾ��ԭ�ӻ�����)
(R1��R2��ʾ��ԭ�ӻ�����)
��R1COOR2��R3CH2COOR4![]()
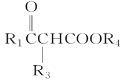 ��R2OH
��R2OH
(R1��R3��ʾ��ԭ�ӻ�������R2��R4��ʾ����)
��ش��������⣺(1)A��B������Ϊ________��
(2)E�����������ŵ�����Ϊ________��
(3)H�Ľṹ��ʽΪ________��(4)I��M�ķ�Ӧ����Ϊ________��
(5)D��F��G�Ļ�ѧ����ʽΪ________________________��
(6)ͬʱ��������������I��ͬ���칹����________��(�����������칹)����дһ�ֺ˴Ź�����������6�����շ��ҷ����֮��Ϊ1��2��2��2��2��1�Ľṹ��ʽΪ_______��
���ܷ�����ɫ��Ӧ��������Ӧ���ڱ�������������ȡ����
(7)��������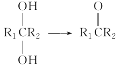 ��Ϣ���Լ���ͱ���Ϊԭ��(�������Լ���ѡ)������Ʊ�
��Ϣ���Լ���ͱ���Ϊԭ��(�������Լ���ѡ)������Ʊ�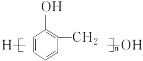 �ĺϳ�·��_______________________��
�ĺϳ�·��_______________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ���ǣ� ��
A. �����Ʊ�ʾ������ԭ�Ӻ����˶��Ĺ켣
B. Fe3�������������Ų�ʽ��3s23p63d5
C. ��̬ԭ�ӵĺ�������Ų�Ϊ[Kr]4d105s1��Ԫ������d��
D. ��̬ͭԭ�ӵ���Χ���ӹ����ʾʽ��![]()
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��һ���¶��£������ܱ������з���N2(g)+3H2(g)![]() 2NH3(g)��Ӧ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��������ƽ��״̬�¸��������ıȽϴ�����ǣ� ��
2NH3(g)��Ӧ����Ӧ�����뷴Ӧʱ��Ĺ�ϵ��ͼ��ʾ��������ƽ��״̬�¸��������ıȽϴ�����ǣ� ��
A.ƽ��״̬��ʱ��c(H2)һ��СB.ƽ��״̬��ʱ��c(NH3)һ����
C.ƽ�ⳣ��Kһ����D.ƽ��״̬��ʱ��v(��)һ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ�Dz��ֶ�����Ԫ��ԭ�Ӱ뾶��ԭ�������Ĺ�ϵͼ������˵����ȷ���ǣ� ��
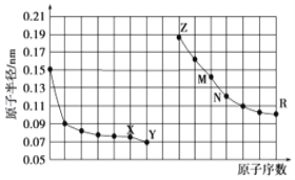
A.M������������Ӧˮ�����ֱܷ���Z��R������������Ӧˮ���ﷴӦ
B.���û�ԭ����ԭR�ļ������Ʊ�R����
C.X��N����Ԫ����ɵĻ������۵�ܵ�
D.�����ӵİ뾶��Z��X��Y
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com