
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L四氯化碳中含有共价键总数为0.4NA
B.46g NO2和N2O4的混合气体中,含有的氮原子数为1NA
C.1L1.0mol/L的盐酸中含有HCl分子数为NA
D.一定条件下,将2molSO2与1molO2充分反应,得到SO3的分子数为2NA
 亮点激活精编提优100分大试卷系列答案
亮点激活精编提优100分大试卷系列答案科目:高中化学 来源: 题型:
【题目】(选用)CuI是一种不溶于水的白色固体,它可以由反应:2Cu2++4I-=2CuI↓+I2 而得到。如图所示装置中,a、b都是惰性电极,通电一段时间后,在KI一淀粉溶液中阳极周围变蓝色,则下列说法正确的是

A.若a极变红,则在Pt电极上:2I--2e-=I2碘遇淀粉变蓝
B.若b极变红,在Pt电极上:4OH--4e-=2H2O+O2,O2将I-氧化为I2,碘遇淀粉变蓝
C.若a极变红,在Cu电极上:开始Cu+I--e-=CuI,一段时间后2I--2e-=I2,碘遇淀粉变蓝
D.若b极变红,在Cu极上:Cu-2e-=Cu2+,Cu2+显蓝色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四种短周期元素在周期表中的位置如图,
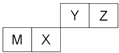
其中只有M为金属元素,下列说法不正确的是( )
A.原子半径Z<M
B.Z位于元素周期表中第二周期、第ⅥA族
C.X的最简单气态氢化物的热稳定性比Z的小
D.X的最高价氧化物不溶于任何酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油化工产品为原料合成聚酯类功能高分子材料R及某药物合成原料E的一种合成路线如下(部分反应条件和产物略去):
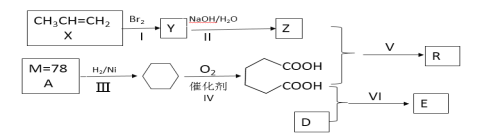
已知D与乙醇属于同系物,E在核磁共振氢谱上有3组峰且峰面积比为2∶2∶3
回答下列问题:
(1)Y的名称是____;R的官能团名称是____;E的分子式是__________。
(2)反应Ⅵ的反应类型是_____;X最多有___________个原子共面。
(3)写出II反应的化学方程式__________________。
(4)写出Y的其余几种同分异构体_________________。
(5)已知: ![]() ,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
,参照上述合成路线,以甲苯和溴乙烷为原料合成苯甲酸乙酯,合成路线是:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。以废铁屑(含有少量Ni)为主要原料制备高铁酸钾的流程如下:
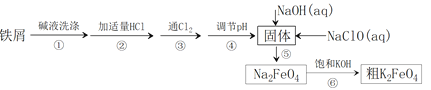
资料显示:一些金属氢氧化物开始沉淀和完全沉淀的pH如下:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)高铁酸钾具有高效消毒主要是因其具有__________性所致。
(2)步骤③反应的离子方程式是_______。
(3)步骤④不能引入新杂质,调节pH所用的某种氧化物的化学式是___________,调节pH的范围是__________________。
(4)步骤⑤发生反应的离子方程式是________。
(5)该流程中可循环利用的物质是:_______(写化学式)。
(6)步骤⑥中,由Na2FeO4 得到粗K2FeO4的原理可能是___________。
(7)测定产品纯度:将wg粗产品,溶入过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1 (NH4)2Fe(SO4)2溶液滴定至终点,消耗滴定液V mL。有关滴定反应有:
Cr(OH)4-+FeO42-+3H2O![]() Fe(OH)3·3H2O↓+CrO42- +OH
Fe(OH)3·3H2O↓+CrO42- +OH
2![]() +2H
+2H![]()
![]() +H2O
+H2O
![]() +6Fe2++14H
+6Fe2++14H![]() 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
该粗产品中K2FeO4的纯度为____________(用含w、c、V的代数式表示)。若滴定管没有用待装液润洗,则测得结果________(“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】前四周期的元素A、B、C、D、E原子序数依次增大;A是宇宙中含量最丰富的元素;B和C同一主族,且B的L层电子数是K层电子数的2.5倍;D和C同一周期,且D的气态氢化物可以和其最高价氧化物的水化物发生氧化还原反应;E位于第四周期,其价电子层中只有一个电子,且内层都处于全充满状态。请回答下列问题:
(1)E原子的电子排布式为________,C和D的第一电离能较大的是________。
(2)CO43-中C的杂化方式为________,该离子的“VSEPR”模型为________形。
(3)C和D的简单阴离子半径由大到小的顺序为________,C和D最高价含氧酸的酸性由弱到强的顺序为________。
(4)某分子的结构式为:A—B=B—A,则该分子中σ键和π键的数目之比为_____,B2分子和一氧化碳分子互为等电子体,则一氧化碳的电子式为_____。
(5)向EDO4溶液中加入过量稀氨水,阳离子化学式为________,该离子的配位体为________。
(6)B能量最高的电子为________轨道上的电子,其轨道呈________形。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料。添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害。其合成线路图如图I所示: 已知以下信息:
①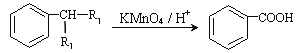
②R1CHO+R2CH2CHO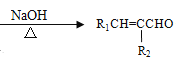 +H2O
+H2O
③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图所示
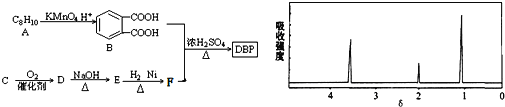
请根据以上信息回答下列问题:
(1)C的结构简式为____________, E中所含官能团的名称是____________;
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1︰1反应生成F:______________________;
②B和F以物质的量比1︰2合成DBP:_____________________,该反应的反应类型为_____________________。
(3)同时符合下列条件的B的同分异构体有______种,写出其中任意两种同分异构体的结构简式_________________。
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeCl3溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮、磷、砷(As)、锑(Sb)、铋(Bi)为元素周期表中的原子序数依次增大的同主族元素。回答下列问题:
(1)N2的电子式为_________;锑在元素周期表中的位置为__________。
(2)![]() 中子数与质子数的差值为________。
中子数与质子数的差值为________。
(3)酸性:H3AsO4__H3PO4(填“>”或”<”)请从元素性质角度解释原因_______。
(4)次磷酸(H3PO2)是一种精细化工产品,具有较强的还原性,可用于化学镀银。
①H3PO2与足量的NaOH溶液反应生成NaH2PO2,则H3PO2是______元酸(填“一”、“二”或“三”)。
②H3PO2可将溶液中的银离子还原为银单质,氧化产物为H3PO4。利用H3PO2进行镀银时,氧化剂与还原剂的物质的量之比为__。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数,下列叙述正确的是
A.常温常压下,1.06g Na2CO3含有的Na+离子数目为0.02 NA
B.常温常压下,2NA个CO2分子占有的体积为44.8L
C.标准状况下,22.4LH2O含有的分子数为 NA
D.物质的量浓度为0.5mol/L的MgCl2溶液中,含有Cl-个数为 NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com