
【题目】塑化剂主要用作塑料的增塑剂,也可作为农药载体、驱虫剂和化妆品等的原料。添加塑化剂(DBP)可改善白酒等饮料的口感,但超过规定的限量会对人体产生伤害。其合成线路图如图I所示: 已知以下信息:
①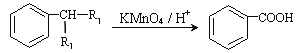
②R1CHO+R2CH2CHO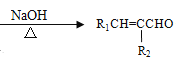 +H2O
+H2O
③C为含两个碳原子的烃的含氧衍生物,其核磁共振氢谱图如图所示
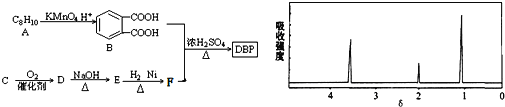
请根据以上信息回答下列问题:
(1)C的结构简式为____________, E中所含官能团的名称是____________;
(2)写出下列有关反应的化学方程式:
①E和H2以物质的量比1︰1反应生成F:______________________;
②B和F以物质的量比1︰2合成DBP:_____________________,该反应的反应类型为_____________________。
(3)同时符合下列条件的B的同分异构体有______种,写出其中任意两种同分异构体的结构简式_________________。
①不能和NaHCO3溶液反应 ②能发生银镜反应
③遇FeCl3溶液显紫色 ④核磁共振氢谱显示苯环上只有一种氢原子
【答案】CH3CH2OH 碳碳双键、醛基 CH3CH=CHCHO+H2![]() CH3CH=CHCH2OH
CH3CH=CHCH2OH ![]() 取代反应 6
取代反应 6  、
、 等
等
【解析】
A反应生成邻苯二甲酸,结合信息①可知A为![]() ,C为含两个碳原子的烃的含氧衍生物,由核磁共振氢谱可知含有3种H原子,结合信息②可知D含有醛基,则C为CH3CH2OH、D为CH3CHO,E为CH3CH2=CHCHO,E和H2以物质的量比1:1反应生成F,B和F以物质的量比1:2合成DBP,合成DBP为酯化反应,则F为CH3CH2=CHCH2OH,DBP为
,C为含两个碳原子的烃的含氧衍生物,由核磁共振氢谱可知含有3种H原子,结合信息②可知D含有醛基,则C为CH3CH2OH、D为CH3CHO,E为CH3CH2=CHCHO,E和H2以物质的量比1:1反应生成F,B和F以物质的量比1:2合成DBP,合成DBP为酯化反应,则F为CH3CH2=CHCH2OH,DBP为![]() ,据此解答.
,据此解答.
解:A反应生成邻苯二甲酸,结合信息①可知A为![]() ,C为含两个碳原子的烃的含氧衍生物,由核磁共振氢谱可知含有3种H原子,结合信息②可知D含有醛基,则C为CH3CH2OH、D为CH3CHO,E为CH3CH2=CHCHO,E和H2以物质的量比1:1反应生成F,B和F以物质的量比1:2合成DBP,合成DBP为酯化反应,则F为CH3CH2=CHCH2OH,DBP为
,C为含两个碳原子的烃的含氧衍生物,由核磁共振氢谱可知含有3种H原子,结合信息②可知D含有醛基,则C为CH3CH2OH、D为CH3CHO,E为CH3CH2=CHCHO,E和H2以物质的量比1:1反应生成F,B和F以物质的量比1:2合成DBP,合成DBP为酯化反应,则F为CH3CH2=CHCH2OH,DBP为![]() .
.
(1)C的结构简式为CH3CH2OH,E为CH3CH2=CHCHO,含有碳碳双键、醛基;
(2)①E和H2以物质的量比1:1反应生成F的方程式为:CH3CH=CHCHO+H2![]() CH3CH=CHCH2OH;
CH3CH=CHCH2OH;
②B和F以物质的量比1:2合成DBP的方程式为:![]() ,属于取代反应;
,属于取代反应;
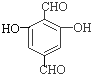
(3)同时符合下列条件的B(![]() )的同分异构体:①不能和NaHCO3溶液反应,不含羧基;②能发生银镜反应,含有醛基;③遇FeC13溶液显紫色,含有酚羟基;④核磁共振氢谱显示苯环上只有一种氢原子,符合条件的同分异构体有:
)的同分异构体:①不能和NaHCO3溶液反应,不含羧基;②能发生银镜反应,含有醛基;③遇FeC13溶液显紫色,含有酚羟基;④核磁共振氢谱显示苯环上只有一种氢原子,符合条件的同分异构体有: 、
、 、
、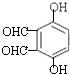 、
、![]() 、
、 、
、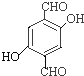 。
。


科目:高中化学 来源: 题型:
【题目】羰基硫(COS)可作为一种粮食熏蒸剂,能防止某些昆虫、线虫和真菌的危害。在恒容密闭容器中,将CO和H2S混合加热并达到下列平衡:CO(g)+H2S(g)![]() COS(g)+H2(g) K=0.1。反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=0.1。反应前CO物质的量为10mol,平衡后CO物质的量为8mol。下列说法正确的是( )
A. 平衡后若升高温度,H2S浓度增加,表明该反应是吸热反应
B. 当体系的压强保持不变时,表明该反应达到化学平衡状态
C. CO的平衡转化率为80%
D. 反应前H2S物质的量为7mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某烃类化合物A用仪器可以测出其相对分子质量为84,分子中含有碳碳双键,分子中只有一种类型的氢。
(1)现有以下的实验室仪器:
A.1H核磁共振仪 B.质谱仪
C.红外光谱仪 D.元素分析仪
请你选择分别用什么仪器
①测出相对分子质量________(填字母,下同)。
②测出官能团碳碳双键________。
③测出几种类型的氢________。
(2)结合题给信息,可以判断A的结构简式为________。
(3)在如图中,D1、D2互为同分异构体,E1、E2互为同分异构体。
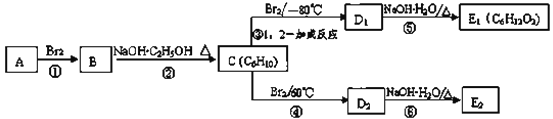
反应②的化学方程式为_________;
C的化学名称为__________;反应类型为:__________。
E2的结构简式是_________;
④、⑤的反应类型依次是________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,2.24L四氯化碳中含有共价键总数为0.4NA
B.46g NO2和N2O4的混合气体中,含有的氮原子数为1NA
C.1L1.0mol/L的盐酸中含有HCl分子数为NA
D.一定条件下,将2molSO2与1molO2充分反应,得到SO3的分子数为2NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验题:
1-溴丙烷是一种重要的有机合成中间体,沸点为71℃,密度为1.36g·cm-3。实验室制备少量 1-溴丙烷的主要步骤如下:
步骤 1:在仪器 A 中加入搅拌磁子、12g 正丙醇及 20mL水,冰水冷却下缓慢加入 28ml浓 H2SO4;冷却至室温,搅拌下加入 24gNaBr。
(已知: ①2NaBr+H2SO4(浓)![]() Na2SO4+2HBr↑
Na2SO4+2HBr↑
②正丙醇和浓硫酸共热会产生丙烯、醚等副产品)
步骤 2:如图所示搭建实验装置,缓慢加热,直到无油状物馏出为止。
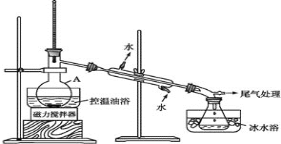
步骤 3:将馏出液转入分液漏斗,分出有机相。
步骤 4:将分出的有机相转入分液漏斗,依次用 12mLH2O、12ml5%Na2CO3 溶液和12mLH2O 洗涤,分液,得粗产品,进一步提纯得 1-溴丙烷。
(1)仪器 A 的名称是_____;
(2)反应时生成的主要有机副产物 2-溴丙烷和_______(答出一种即可给分)
(3)步骤 2 中需向接收瓶内加入少量冰水并置于冰水浴中的目的是____。
(4)步骤 1 中浓 H2SO4 用水稀释,待冷却至室温后再加 NaBr 的目的是______。步骤 4 中用 Na2CO3 溶液洗涤的目的是_____。
(5)步骤 4 中进一步提纯 1-溴丙烷的方法是_________;在进行此操作之前需要 用无水MgBr2 处理粗产品,其目的是_____。
(6)1-溴丙烷在一定条件下也可以制备 1-丙醇,请写出由产物 1-溴丙烷制备 1-丙醇的化学反应方程式________________________ 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化不能实现的是( )
A.Fe(s)![]() FeCl3(s)
FeCl3(s)![]() Fe(OH)3(s)
Fe(OH)3(s)
B.CaCl2(aq)![]() CaCO3(s)
CaCO3(s)![]() CaO(s)
CaO(s)
C.NaHCO3(s)![]() Na2CO3(s)
Na2CO3(s)![]() NaOH(s)
NaOH(s)
D.Al2O3(s)![]() AlCl3(aq)
AlCl3(aq) ![]() Al(OH)3 (s)
Al(OH)3 (s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨工业对国民经济和社会发展具有重要的意义。对于密闭容器中的反应:![]() ,
,![]() ,
,![]() 下
下![]() 和
和![]() 随时间变化的关系如下图所示。下列叙述正确的是( )
随时间变化的关系如下图所示。下列叙述正确的是( )
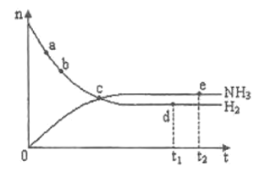
A.点a的正反应速率比点b的大
B.点c处反应达到平衡
C.点d(![]() 时刻)处
时刻)处![]() 大于点e(
大于点e(![]() 时刻)处
时刻)处![]()
D.其他条件不变,![]() 下反应至
下反应至![]() 时刻达到平衡,则此时n(H2)比上图中d点的值大
时刻达到平衡,则此时n(H2)比上图中d点的值大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】肉桂酸(M)是医药、香料的中间体,实验室由芳香化合物A制备M的一种合成路线如下:
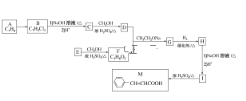
已知:①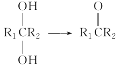 (R1、R2表示氢原子或烃基)
(R1、R2表示氢原子或烃基)
②R1COOR2+R3CH2COOR4![]()
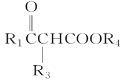 +R2OH
+R2OH
(R1、R3表示氢原子或烃基,R2、R4表示烃基)
请回答下列问题:(1)A→B的条件为________。
(2)E中所含官能团的名称为________。
(3)H的结构简式为________。(4)I→M的反应类型为________。
(5)D+F→G的化学方程式为________________________。
(6)同时满足下列条件的I的同分异构体有________种(不考虑立体异构),任写一种核磁共振氢谱中有6组吸收峰且峰面积之比为1:2:2:2:2:1的结构简式为_______。
①能发生显色反应和银镜反应 ②苯环上连有两个取代基
(7)参照上述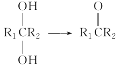 信息,以甲烷和苯酚为原料(其他无机试剂任选),设计制备
信息,以甲烷和苯酚为原料(其他无机试剂任选),设计制备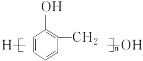 的合成路线_______________________。
的合成路线_______________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用密度为1.25 g/mL、质量分数为36.5%的浓盐酸配制240 mL 0.1 mol/L的盐酸,请回答下列问题:
(1)浓盐酸的物质的量浓度为_________。
(2)配制 240 mL 0.1mol/L的盐酸。
应量取浓盐酸体积/mL | 应选用容量瓶的规格/mL |
______ | ______ |
(3)配制时,其正确的操作顺序是(字母表示,每个字母只能用一次 )_________
A. 用30 mL水洗涤烧杯内壁和玻璃棒23次,洗涤液均注入容量瓶,振荡
B. 用量筒淮确量取所需的浓盐酸的体积,倒入烧杯中,再加入少量水(约30 mL),用玻璃棒慢慢搅动,使其混合均匀
C. 将已冷却的盐酸沿玻璃棒注入容量瓶中
D. 将容量瓶盖紧,振荡,摇匀
E. 改用胶头滴管加水,使溶液凹液面恰好与刻度线相切
F. 继续往容量瓶内小心加水,直到液面接近刻度线12 cm处
(4)若实验中遇到下列情况,对盐酸溶液的物质的量浓度有何影响(填“偏高”、“偏低”或“不变”)?
①用于稀释盐酸的烧杯未洗涤_________。
②容量瓶中原有少量蒸馏水_________。
③定容时观察液面俯视_________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com