
【题目】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有___ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为____________________________。
(2)经测定发现,N2O5固体由NO2+ 和NO3-两种离子组成,该固体中N原子杂化类型为_________;与NO2+互为等电子体的微粒有_______(写出一种)。
(3)HF和HI电离出H+较难的是________(填化学式,下同)。铵盐大多不稳定,请预测NH4F、NH4I中,较易分解的是________。
(4)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(5)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体( 见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由_______个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),那么该结构单元有_____种不同类型。
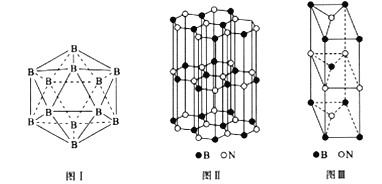
(6)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,B、N原子相互交替排列(见图II),其晶胞结构如图III所示。该晶胞有_____个B和_____个N。
【答案】 七(或“7”) 哑铃形 sp、sp2 SCN-、CO2、CS2、N3-等中的任一种 HF NH4F Be、C、O 12 3 2 2
【解析】(1)N原子核外共有7个电子,也就是有7种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道为p轨道,其形状为哑铃形。
(2)NO2+ 和NO3-的中心原子的价层电对数分别为2和3,故该固体中N原子杂化类型为sp、sp2;与NO2+互为等电子体的微粒有SCN-、CO2、CS2、N3-。
(3)由于H—F键的键能较大、不易断裂、容易形成,故HF和HI相比,电离出H+较难的是HF,同理,NH4F与NH4I相比,较易分解的是NH4F。
(4) 第二周期中,第一电离能呈逐渐增大的趋势,由于Be和N原子的原子结构比其同周期邻近的两个原子稳定,故其第一电离能高于其邻近的两种元素,即B<Be<C<O<N,所以,第一电离能介于B元素和N元素间的元素为Be、C、O。
(5)由图可知,每个B参与形成5个面、每个面有3个B,共有20个面,则每一个此基本结构单元由![]() 12个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),由于B原子在结构单元中只有3种位置关系,所以该结构单元有3种不同类型。
12个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),由于B原子在结构单元中只有3种位置关系,所以该结构单元有3种不同类型。
(6)由图III可知,B原子位于晶胞的顶点,N原子位于晶胞的2个面心和4条棱上,所以该晶胞含有B的数目为![]() 2个、含有N原子的数目为
2个、含有N原子的数目为![]() 2个。
2个。


 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
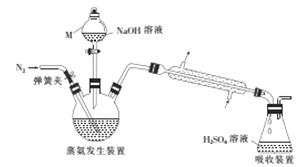
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,23g NO2含有NA个氧原子
B.标准状况下,22.4L H2O含有NA个H2O分子
C.含10 NA个电子的N2分子的物质的量是1mol
D.0.1mol/L的Ba(OH)2溶液中,OH﹣的个数为0.2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中可以大量共存的一组是( )
A. H+、Na+、OH﹣
B. Na+、NO3﹣、Cl﹣
C. K+、H+、HCO3﹣
D. Ca2+、SO42﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
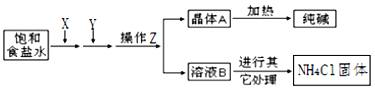
(1)在饱和食盐水中通入X和Y,则X______和Y_______(填物质名称),先通X后通Y的原因是_______________________。
(2)写出通入X和Y的化学反应方程式____________________________。
(3)操作Z包括________和________(填名称)。
(4)溶液B中含有的主要离子是_____________,为了得到化肥(NH4Cl),需要在溶液B中通入NH3、冷冻、加食盐,其中通入NH3的作用一_______________________________,作用二_______________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
① 称取样品ag,加水溶解;
② 加入足量的BaCl2溶液;
③ 过滤、_________、烘干、冷却、称量、烘干、冷却、_________,最终得到固体bg。样品中纯碱的质量分数为___________________(用含a、b的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙以及物质D、E、F、G、H,它们之间的相互转化关系如图所示(图中有些反应的生成物和反应的条件没有标出)。

请回答下列问题:
(1)写出下列物质的化学式:B________、乙________。
(2)写出下列反应的离子方程式:
反应①____________________________________;
反应⑤____________________________________;
反应⑥____________________________________。
(3)将0.4 g D和1.06 g Na2CO3混合并配成溶液,向混合溶液中逐滴滴加0.1 mol·L-1稀盐酸。在如下图所示的坐标系中画出能正确表示加入盐酸的体积和生成CO2的物质的量的关系图像。________________

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于氮及其化合物的说法正确的是
A.NO2是酸性氧化物B.NO、NO2均为大气污染气体,都可用水来吸收处理
C.NH3易液化,常用作制冷剂D.NO能与O2反应生成无色气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、完成下列填空。
(1)第三周期中,第一电离能最小的元素是___________,第一电离能最大的元素是___________。(填元素符号)
(2)分子中σ键数目:C2H4_____CH4 ;原子轨道能量:3d___________4s(用“>”或“<”完成下列填空)
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的___________键更稳定(填“σ”或“π”)
II、A、B、C代表3种元素。请填空:
(1)A的原子的3p轨道上只有1个电子的自旋方向与其他电子的自旋方向相反,写出该原子价电子的轨道表示式:_______________________________,核外电子运动状态有_______种。
(2)B是原子序数为35的元素,其原子中有___________个电子层,有_________个能级。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,元C素基态原子的电子排布式为____________________________,其单质在一定条件下能与浓硫酸反应,试写出该反应方程式:____________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用NA表示阿伏加德罗常数的值,下列说法正确的是
A. 24 g Mg变为Mg2+时失去的电子数为2 NA
B. 1 mol OH-中含有的电子数为9 NA
C. 常温常压下,22.4 L H2中含有氢分子的个数为NA
D. 1mol / L NaCl溶液中含有钠离子的个数为NA
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com