
【题目】I、完成下列填空。
(1)第三周期中,第一电离能最小的元素是___________,第一电离能最大的元素是___________。(填元素符号)
(2)分子中σ键数目:C2H4_____CH4 ;原子轨道能量:3d___________4s(用“>”或“<”完成下列填空)
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的___________键更稳定(填“σ”或“π”)
II、A、B、C代表3种元素。请填空:
(1)A的原子的3p轨道上只有1个电子的自旋方向与其他电子的自旋方向相反,写出该原子价电子的轨道表示式:_______________________________,核外电子运动状态有_______种。
(2)B是原子序数为35的元素,其原子中有___________个电子层,有_________个能级。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,元C素基态原子的电子排布式为____________________________,其单质在一定条件下能与浓硫酸反应,试写出该反应方程式:____________________________。
【答案】 Na Ar > > π ![]() 16 4 8 [Ar]3d104s1 Cu + 2 H2SO4(浓)= CuSO4+SO2↑+2H2O
16 4 8 [Ar]3d104s1 Cu + 2 H2SO4(浓)= CuSO4+SO2↑+2H2O
【解析】(1)一般来说,同周期从左到右,元素的第一电离能力渐增大的趋势(除第ⅡA族.第VA族元素反常外);同周期碱金属中钠元素的第一电离能最小,稀有气体元素的第一电离能最大,故第三周期中第一电离能最小的元素为钠,最大的元素为Ar;正确答案:. Na ;Ar。
(2)C2H4含有σ键数目为5,CH4中含有σ键数目为1,所以C2H4大于CH4 ;原子轨道的能量高低顺序是:![]() ,所以
,所以![]() ,原子轨道能量:3d大于4s;正确答案:> ; >。
,原子轨道能量:3d大于4s;正确答案:> ; >。
(3)![]() 中含有2个
中含有2个![]() 键,1个
键,1个![]() 键,已知
键,已知![]() 键能为
键能为![]() ,
,![]() 单键键能为
单键键能为![]() ,则1个
,则1个![]() 键的键能为
键的键能为![]() ,则
,则![]() 中的
中的![]() 键键能大于
键键能大于![]() 键键能,较稳定;正确答案π 。
键键能,较稳定;正确答案π 。
II、(1)A的原子的3p轨道上只有1个电子的自旋方向与其他电子的自旋方向相反,该原子价电子的轨道表示式:![]() ;有多少个电子,就有多少种运动状态,所以该原子核电荷数为16,核外电子运动状态,16种;正确答案:
;有多少个电子,就有多少种运动状态,所以该原子核电荷数为16,核外电子运动状态,16种;正确答案:![]() ;16。
;16。
(1)B的原子的2p轨道上只有1个电子的自旋方向与其他电子的自旋方向相反,则该原子价电子的轨道表示式为![]() 。
。
(2)根据B是原子序数为35,其核外电子排布为:1s2 2s2 2p6 3s2 3p6 3d10 4s2 4P5,其原子中有4个电子层,有8个能级;正确答案:4;8。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,则C的电子排布式应为![]() 或[Ar]3d104s1;所以C
或[Ar]3d104s1;所以C


科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为________个。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为________。![]() 的沸点比
的沸点比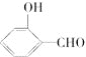 高,原因是__________________________。
高,原因是__________________________。
(3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有___ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为____________________________。
(2)经测定发现,N2O5固体由NO2+ 和NO3-两种离子组成,该固体中N原子杂化类型为_________;与NO2+互为等电子体的微粒有_______(写出一种)。
(3)HF和HI电离出H+较难的是________(填化学式,下同)。铵盐大多不稳定,请预测NH4F、NH4I中,较易分解的是________。
(4)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(5)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体( 见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由_______个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),那么该结构单元有_____种不同类型。
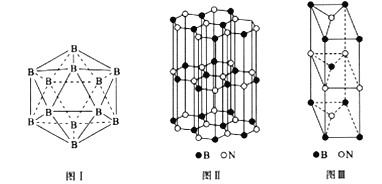
(6)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,B、N原子相互交替排列(见图II),其晶胞结构如图III所示。该晶胞有_____个B和_____个N。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式,书写正确的是
A. 钠投入水中:Na+H2O=Na++OH-+H2↑
B. 硫酸氢钠溶液与NaOH溶液混合:H++OH-=H2O
C. 氢氧化钡溶液和稀硫酸混合:Ba2++OH-+H++SO42-=BaSO4↓+H2O
D. 盐酸与石灰石反应制备二氧化碳:CO32-+2H+=CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2;②1s22s22p63s23p3;③1s22s22p4;④1s22s22p3。则下列有关比较中正确的是( )
A. 电负性:④>③>②>①
B. 原子半径:③>④>②>①
C. 第一电离能:④>③>②>①
D. 最高正化合价:③>④=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,由N2O和CO2组成的混合气体的密度是C2H4、N2和H2组成的混合气体密度的 2倍,则C2H4、N2和H2组成的混合气体中H2的质量分数为
A. 3/13 B. 10/13 C. 大于3/13,小于10/13 D. 3/143
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中错误的是( )
A.在共价化合物中可能含有离子键
B.非金属元素之间形成的化合物不一定是共价化合物
C.含有共价键的化合物不一定是共价化合物
D.含有离子键的化合物一定是离子化合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某校“研究性学习小组”欲完成反应2HCl+2Ag===2AgCl+H2↑而设计了下列四个实验,你认为可行的是( )

A. A B. B C. C D. D
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com