
【题目】氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为________个。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为________。![]() 的沸点比
的沸点比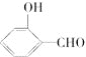 高,原因是__________________________。
高,原因是__________________________。
(3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_____________________________________。
 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案科目:高中化学 来源: 题型:
【题目】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用c表示)包括三类:主要为Al3+中的单体形态铝(用Ala表示)总浓度,主要为 [AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝(用Alc表示)总浓度。
(1)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
②6AlCl(g)=4Al(s)+2AlCl3(g) ΔH2=bkJ·mol-1
则反应Al2O3(s) +3C(s)=2Al (s)+3CO(g) 说明ΔH=_______kJ·mol-1(用含a、b的代数式表示)。
_0( 填“>”或“<”)。
反应①在常压、1900℃的高温下才能进行,说明ΔH_______0(填“>”、“<”或“=”)
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝溶液中铝形态分布(百分数)如右表:
AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,Al(OH)3胶体的百分含量________(填“越大”“越小”或“不变”)。
②若将c=2.520mol/L的聚合氧化铝溶液加水稀释,则稀释过程中发生的主要反应的离子方程式为_________________________________。
(3)一定条件下,向1.0mol/L的AlCl溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86% 的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_________________________。
(4)已知Al3++4X![]() 2
2![]() ,X表示显色剂,
,X表示显色剂,![]() 表示有色物质,通过比色分析得
表示有色物质,通过比色分析得
到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194 mol·L-1)。
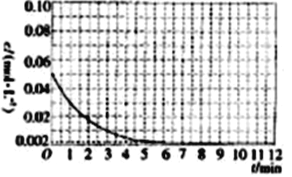
①1min时, ![]() 的浓度为___________。
的浓度为___________。
②0~3min内该反应的速率vx=________。
③第9min时,反应达到平衡,K=__________(用代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
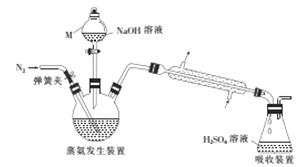
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】恒温、恒压下,在一个容积可变的容器中发生如下反应:A(g)+B(g)![]() C(g)。
C(g)。
(1)若开始时放入1 mol A和1 mol B,达到平衡后,生成amol C。这时A的物质的量为________mol。
(2)若开始时放入3 mol A和3 mol B,达到平衡后,生成C的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒
F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为________mL。
(2)实验时选用的仪器有(填序号)________。
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_________。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏伽德罗常数的值,下列说法正确的是( )
A.常温常压下,23g NO2含有NA个氧原子
B.标准状况下,22.4L H2O含有NA个H2O分子
C.含10 NA个电子的N2分子的物质的量是1mol
D.0.1mol/L的Ba(OH)2溶液中,OH﹣的个数为0.2NA个
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子在溶液中可以大量共存的一组是( )
A. H+、Na+、OH﹣
B. Na+、NO3﹣、Cl﹣
C. K+、H+、HCO3﹣
D. Ca2+、SO42﹣、CO32﹣
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I、完成下列填空。
(1)第三周期中,第一电离能最小的元素是___________,第一电离能最大的元素是___________。(填元素符号)
(2)分子中σ键数目:C2H4_____CH4 ;原子轨道能量:3d___________4s(用“>”或“<”完成下列填空)
(3)N≡N的键能为942kJ·mol-1,N—N单键的键能为247kJ·mol-1,通过计算说明N2中的___________键更稳定(填“σ”或“π”)
II、A、B、C代表3种元素。请填空:
(1)A的原子的3p轨道上只有1个电子的自旋方向与其他电子的自旋方向相反,写出该原子价电子的轨道表示式:_______________________________,核外电子运动状态有_______种。
(2)B是原子序数为35的元素,其原子中有___________个电子层,有_________个能级。
(3)C元素基态原子的M层全充满,N层没有成对电子,只有一个未成对电子,元C素基态原子的电子排布式为____________________________,其单质在一定条件下能与浓硫酸反应,试写出该反应方程式:____________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com