
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒
F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为________mL。
(2)实验时选用的仪器有(填序号)________。
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_________。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
【答案】5.4 CEFGH ① BCD
【解析】
(1)在100 mL 1.0 mol·L-1稀硫酸中含有溶质的物质的量是n(H2SO4)=c·V=1.0mol/L×0.1L=0.1mol,密度为1.84 g/cm3的98%的浓硫酸的物质的量浓度是![]() ,则根据溶液在稀释过程中溶质的物质的量不变可知需要浓硫酸的体积是V=0.1mol÷18.4mol/L=0.0054L=5.4mL;
,则根据溶液在稀释过程中溶质的物质的量不变可知需要浓硫酸的体积是V=0.1mol÷18.4mol/L=0.0054L=5.4mL;
(2)选择仪器的标准是“大而近”,因此应该选择10 mL量筒,在烧杯中进行稀释,为了促进物质溶解要用玻璃棒搅拌,当溶液恢复至室温后,用玻璃棒引流转移溶液至已经查漏的100 mL容量瓶中,洗涤烧杯和玻璃棒后,再加水,当液面离刻度线1~2cm时,改用胶头滴管滴加。故使用的仪器的代号是CEFGH;
(3)①定容时俯视刻度线观察液面,则溶液的体积偏小,根据c=n/V可知配制的溶液浓度偏高;
②容量瓶使用时未干燥,由于不影响溶液的体积和溶质的物质的量,因此对配制的溶液的浓度无影响;
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线,会使溶液的体积偏大,则根据c=n/V可知配制的溶液浓度偏低。
答案选①;
(4)A.容量瓶是配制溶液的仪器,由于最后溶液要摇匀,所以使用容量瓶前检查它是否漏水,A正确;
B.容量瓶用蒸馏水洗净后,再用待配液润洗,会使溶质的物质的量偏多,导致配制的溶液的浓度偏高,B错误;
C.氢氧化钠有腐蚀性,不能在托盘天平上直接称量,应该在烧杯中进行处理,而且物质溶解要在烧杯中进行,当溶液恢复至室温后,再用玻璃棒引流转移溶液至容量瓶中,C错误;
D.浓硫酸应该在烧杯中进行稀释,不能直接在容量瓶中进行,D错误;
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转,反复颠倒,摇匀,使溶液的浓度均匀、一致,E正确。
所以不正确的操作是BCD。


科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类水解产物或水解过程的叙述中正确的是
A. 所有的糖类都能发生水解反应生成单糖
B. 蔗糖与麦芽糖的水解产物相同
C. 淀粉在人体内直接水解成葡萄糖
D. 在酸的催化作用下,淀粉和纤维素都可以水解成葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以铬铁矿[主要成分为Fe(CrO2)2;还含有Al2O3、Fe2O3、SiO2等杂质]为主要原料生产重铬酸钠晶体(Na2Cr2O7·2H2O,Na2Cr2O7是一种强氧化剂)的主要工艺流程如下:
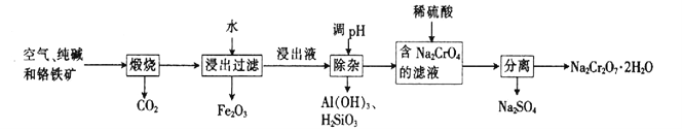
(1)亚铬酸亚铁[Fe(CrO2)2]中Cr的化合价是___________。
(2)煅烧生成Na2CrO4的化学方程式为___________。
(3)酸化滤液Na2CrO4时,不选用赴酸的原因是____________________,从平衡角度分析酸化的原理:______________________。
(4)该工艺中某种产物可以再利用,该物质的化学式为________________。
(5)采用石墨电极电解Na2CrO4溶液,可实现Na2CrO4→Na2Cr2O7的转化,其原理如图所示。,
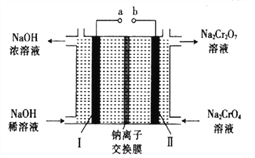
①写出Ⅰ电极的电极反应式_______________________。
②当Na2CrO4转化为1malNa2Cr2O7时,理轮上Ⅱ电极上转移电子的物质的量为________。
(3)称取2.500g重铬酸钠晶体试样,加入蒸馏水配制成250ml溶液,从中取出25.00mL于碘量瓶中,向其中加入10mL2mol·L-1 H2SO4溶液和足量碘化钾(铬的还原产物为Cr3+),放于暗处5min。然后加入100mL水,加入3mL淀粉指示剂,用0.120mol·L-1的Na2S2O3标准溶液进行滴定(发生反应:I2+2S2O32-=2I-+S4O62-)。
①判断达到滴定终点的依据是______________________。
②若实验中共用去40.00mL,Na2S2O3标准溶液。则所得产品的纯度为_____________(设整个过程中其他杂质不参如反应)(保留3位有效数字)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】欧美三位科学家因“分子机器的设计与合成”研究而荣获2016年诺贝尔化学奖。纳米分子机器研究进程中常见机器的“车轮”组件如下图所示。下列说法正确的是

A. ①③互为同系物 B. ①②③④均属于烃
C. ①④的一氯代物均为三种 D. ②④互为同分异构体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为________个。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为________。![]() 的沸点比
的沸点比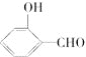 高,原因是__________________________。
高,原因是__________________________。
(3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
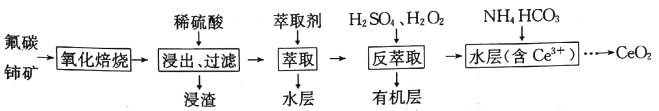 已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________、__________ (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:__________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________(用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________。在“反萃取”后所得水层中加入1.0mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)约为__________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2SO4 的质量为98 g·mol-1 B. 常温常压下11.2LCO2所含分子数为0.5NA
C. H2SO4 的摩尔质量为98 g D. 6.02×1022个H2SO4分子的质量为9.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2;②1s22s22p63s23p3;③1s22s22p4;④1s22s22p3。则下列有关比较中正确的是( )
A. 电负性:④>③>②>①
B. 原子半径:③>④>②>①
C. 第一电离能:④>③>②>①
D. 最高正化合价:③>④=②>①
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com