
【题目】下列关于糖类水解产物或水解过程的叙述中正确的是
A. 所有的糖类都能发生水解反应生成单糖
B. 蔗糖与麦芽糖的水解产物相同
C. 淀粉在人体内直接水解成葡萄糖
D. 在酸的催化作用下,淀粉和纤维素都可以水解成葡萄糖
 金牌教辅培优优选卷期末冲刺100分系列答案
金牌教辅培优优选卷期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A.过滤时,不可将悬浊液从烧杯中直接倒入漏斗中
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,现将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
D.只要是液体混合物就可以用蒸馏来分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出
B. 工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去废水中的Hg2+
C. 水中的Mg(HCO3)2、Ca(HCO3)2受热易分解生成难溶性的MgCO3、CaCO3,故水垢的主要成分是MgCO3、CaCO3
D. 珊瑚虫从周围海水中获取Ca2+和![]() ,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】磷化铜(Cu3P2)用于制造磷青铜,磷青铜是含少量锡、磷的铜合金,主要用作耐磨零件和弹性原件。
(1)基态铜原子的电子排布式为______;价电子中成对电子数有____个。
(2)磷化铜与水作用产生有毒的磷化氢(PH3)。
①PH3分子中的中心原子的杂化方式是_________。
②P与N同主族,其最高价氧化物对应水化物的酸性:HNO3___H3PO4(填“>”或“<”),从结构的角度说明理由:__________________________。
(3)磷青铜中的锡、磷两元素电负性的大小为Sn___P(填“>”“<”或“=”)。
(4)某磷青铜晶胞结构如图所示。
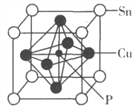
①则其化学式为________。
②该晶体中距离Cu原子最近的Sn原子有______个,这些Sn原子所呈现的构型为_________。
③若晶体密度为8.82g·cm-3,最近的Cu原子核间距为____pm(用含NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向平底烧瓶中放入氢氧化钡晶体[Ba(OH)2·8H2O]和氯化铵晶体,塞紧瓶塞。在瓶底和木板间滴少量水,如下图所示,一会儿,就会发现瓶内固态物质变稀,有液体生成,瓶壁变冷,小木板因少量水结冰冻结,而将烧瓶黏住,这时打开瓶塞,散发出来的气体有氨味。这是自发地发生了反应:Ba(OH)2·8H2O(s)+2NH4Cl(s)===BaCl2(s)+2NH3(g)+10H2O(l)。实验中的下列结论正确的是( )

A. 自发反应一定是放热反应
B. 自发反应一定是吸热反应
C. 有的吸热反应也能自发进行
D. 吸热反应不能自发进行
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某浅绿色晶体X[x(NH4)2SO4·yFeSO4·zH2O]在分析化学中常用作还原剂. 为确定其组成,某小组同学进行如下实验.
I.NH4+的测定
采用蒸馏法,蒸馏装置如图所示。
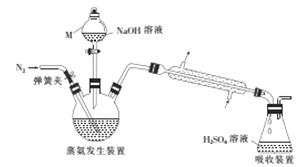
相关的实验步骤如下:
①准确称取58.80g晶体X,加水溶解后,将溶液注入三颈烧瓶中;
②准确量取50.00mL3.0300molL-1H2SO4溶液于锥形瓶中;
③向三颈烧瓶中加入足量NaOH溶液,通入氮气,加热,蒸氨结束后取下锥形瓶;
④用0.120molL-1NaOH标准溶液滴定锥形瓶中过量的硫酸,滴定终点时消耗25.00mL NaOH标准溶液.
(1)仪器M的名称为__________。
(2)步骤③中,发生的氧化还原反应的化学方程式为____________。蒸氨结束后,为了减少实验误差,还需要对直形冷凝管进行“处理”,“处理”的操作方法是_____________。
(3)步骤④中,若振荡时锥形瓶中有液体溅出,则所测得的n(NH4+)的值将______(填“偏大”“偏小”或“不变”)。
II.SO42-含量的测定
采用重量分析法,实验步骤如下:
①另准确称取58.80g晶体X 于烧杯中,加水溶解,边搅拌边加入过量的BaCl2溶液;
②将得到的溶液用无灰滤纸(灰分质量很小,可忽略)过滤,洗涤沉淀3~4次;
③用滤纸包裹好沉淀取出,灼烧滤纸包至滤纸完全灰化;
④继续灼烧沉淀至恒重、称量,得沉淀质量为69.90g。
(4)步骤①中,判断BeCl 溶液已过量的实验操作和现象是___________。
(5)步骤②中,采用冷水洗讓沉淀,其主要目的是___________。
(6)结合实验Ⅰ、Ⅱ通过计算得出晶体X的化学式为__________。实验I 的步骤①中,溶液中离子溶度由大到小的顺序为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中H2O只做还原剂的是( )
A.2Na+2H2O═2NaOH+H2↑
B.2H2O═2H2↑+O2↑
C.2F2+2H2O═4HF+O2
D.CaO+H2O═Ca(OH)2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓硫酸(其密度为1.84 g/cm3)配制100 mL 1.0 mol·L-1稀硫酸,若实验仪器有:
A.100 mL量筒 B.托盘天平 C.玻璃棒 D.50 mL容量瓶 E.10 mL量筒
F.胶头滴管 G.50 mL烧杯 H.100 mL容量瓶
(1)需量取浓硫酸的体积为________mL。
(2)实验时选用的仪器有(填序号)________。
(3)配制过程中,下列情况会使配制结果偏高的是(填序号)_________。
①定容时俯视刻度线观察液面
②容量瓶使用时未干燥
③定容后经振荡、摇匀、静置,发现液面低于刻度线,再加蒸馏水补至刻度线
(4)在容量瓶使用方法中,下列操作不正确的是(填序号)________。
A.使用容量瓶前检查它是否漏水
B.容量瓶用蒸馏水洗净后,再用待配液润洗
C.将氢氧化钠固体放在天平托盘的滤纸上,准确称量并放入烧杯中溶解后,立即注入容量瓶中
D.将准确量取的18.4 mol·L-1的硫酸,注入已盛有30 mL水的100 mL的容量瓶中,加水至刻度线
E.定容后塞好瓶塞,用食指顶住瓶塞,用另一只手的手指托住瓶底,把容量瓶倒转摇匀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
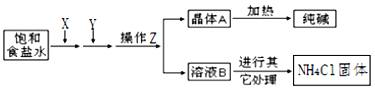
(1)在饱和食盐水中通入X和Y,则X______和Y_______(填物质名称),先通X后通Y的原因是_______________________。
(2)写出通入X和Y的化学反应方程式____________________________。
(3)操作Z包括________和________(填名称)。
(4)溶液B中含有的主要离子是_____________,为了得到化肥(NH4Cl),需要在溶液B中通入NH3、冷冻、加食盐,其中通入NH3的作用一_______________________________,作用二_______________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
① 称取样品ag,加水溶解;
② 加入足量的BaCl2溶液;
③ 过滤、_________、烘干、冷却、称量、烘干、冷却、_________,最终得到固体bg。样品中纯碱的质量分数为___________________(用含a、b的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com