
【题目】下列说法中正确的是( )
A. 钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出
B. 工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去废水中的Hg2+
C. 水中的Mg(HCO3)2、Ca(HCO3)2受热易分解生成难溶性的MgCO3、CaCO3,故水垢的主要成分是MgCO3、CaCO3
D. 珊瑚虫从周围海水中获取Ca2+和![]() ,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
 科学实验活动册系列答案
科学实验活动册系列答案科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.氯化钠中混有少量单质碘杂质,可用升华的方法提纯
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.SO2可使酸性高锰酸钾溶液褪色,体现了SO2的漂白性
D.浓硫酸具有吸水性,可以用作干燥剂,例如可用于NH3的干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氯碱工业的盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下:
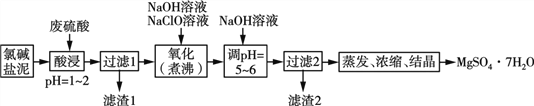
(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为___________________;滤渣1的主要成分为CaSO4和____(填化学式);为了提高浸取率可采取的措施有____(填字母)。
a. 多次用废硫酸浸取 b. 减小盐泥粒度并充分搅拌
c. 延长浸取时间 d.适当的提高酸浸的温度
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__________________;滤渣2为MnO2和____、____(填化学式)。
(3) 镁的碳化物常见的有MgC2和Mg2C3两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为________ 。
(4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿立呱陛(A)是一种新的抗精神分裂症药物,可由化合物B,C,D 在有机溶剂中通过以下两条路线合成得到。
A: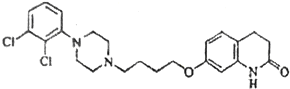
B: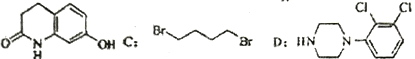
线路一:![]()
线路二:![]()
(1)E的结构简式为______________,其含氧官能团有_________(写名称)。
(2)由C,D 生成化合物F 的反应类型是_____________。化合物C与足量的NaOH乙醇溶液共热反应的产物的名称是_________________。
(3)H 属于氨基酸,与B 的水解产物互为同分异构体。H 能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2 种。写出一种满足上述条件的H 的结构简式_________________。
(4)合成F (相对分子质量为366) 时还可能生成一种相对分子质量为285 的副产物G,G 能使溴水褪色,G 的结构简式为_________________。
(5)已知: 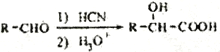 写出由C制备
写出由C制备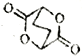 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
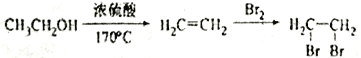 _____________________
_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(ρ=1.84g/ml)配制 1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是( )
① 玻璃棒 ② 胶头滴管 ③ 100mL容量瓶 ④ 托盘天平 ⑤ 50mL烧杯 ⑥10mL量筒
⑦ 100mL量筒 ⑧ 移液管 ⑨ 滴定管
A.⑥③⑧⑤①② B.⑥⑤③①⑨② C.④⑤③②①⑨ D.⑥⑤①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)在标准状况下8.96 L CH4的质量是__________g,含__________个氢原子。
(2)将标准状况下22.4 L的HCl 溶于水配成200 mL的溶液,所得溶液的物质的量浓度为______________;配制300 mL 0.5 mol·L-1氯化钠溶液,需要1.5 mol·L-1的氯化钠溶液的体积是______________ mL。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类水解产物或水解过程的叙述中正确的是
A. 所有的糖类都能发生水解反应生成单糖
B. 蔗糖与麦芽糖的水解产物相同
C. 淀粉在人体内直接水解成葡萄糖
D. 在酸的催化作用下,淀粉和纤维素都可以水解成葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
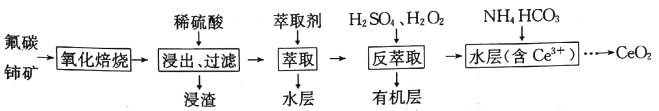 已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________、__________ (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:__________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________(用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________。在“反萃取”后所得水层中加入1.0mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)约为__________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com