
【题目】利用氯碱工业的盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下:
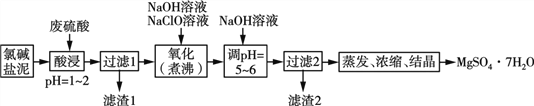
(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为___________________;滤渣1的主要成分为CaSO4和____(填化学式);为了提高浸取率可采取的措施有____(填字母)。
a. 多次用废硫酸浸取 b. 减小盐泥粒度并充分搅拌
c. 延长浸取时间 d.适当的提高酸浸的温度
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__________________;滤渣2为MnO2和____、____(填化学式)。
(3) 镁的碳化物常见的有MgC2和Mg2C3两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为________ 。
(4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理:____________________________________。
【答案】 FeCO3+2H+![]() Fe 2++CO2↑+H2O SiO2 abcd Mn2++2OH-+ClO-
Fe 2++CO2↑+H2O SiO2 abcd Mn2++2OH-+ClO-![]() MnO2↓+Cl-+H2O(或Mn2++H2O+ClO-
MnO2↓+Cl-+H2O(或Mn2++H2O+ClO-![]() MnO2↓+Cl-+2H+ Fe(OH)3 Al(OH)3 Mg2+[∶CC∶]2- 4MgCO3·Mg(OH)2·5H2O
MnO2↓+Cl-+2H+ Fe(OH)3 Al(OH)3 Mg2+[∶CC∶]2- 4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O
5MgO+4CO2↑+6H2O
【解析】(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为FeCO3+2H+=Fe 2++CO2↑+H2O;盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]中只有二氧化硅不溶于硫酸,同时碳酸钙与硫酸反应会生成硫酸钙沉淀,因此滤渣1的主要成分为CaSO4和SiO2; a. 多次用废硫酸浸取,可以使盐泥中的物质充分溶解;b. 减小盐泥粒度并充分搅拌,c. 延长浸取时间,d.适当的提高酸浸的温度,都可以提高浸取率,故选abcd,故答案为:FeCO3+2H+=Fe 2++CO2↑+H2O;SiO2;abcd;
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为Mn2++2OH-+ClO- =MnO2↓+Cl-+H2O,调节pH=5~6,可以沉淀铁离子、铝离子,形成氢氧化铁和氢氧化铝沉淀,故滤渣2为MnO2和Fe(OH)3、Al(OH)3,故答案为:Mn2++2OH-+ClO-=MnO2↓+Cl-+H2O;Fe(OH)3、Al(OH)3;
(3) MgC2发生水解反应生成乙炔,则MgC2与碳化钙的结构相似,电子式为Mg2+![]() ,故答案为:Mg2+
,故答案为:Mg2+![]() ;
;
(4)碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]受热分解生成氧化镁和二氧化碳,以及水,氧化镁熔点较高,可以覆盖在可燃物表面,起到隔绝氧气的作用,同时二氧化碳和水也可以帮助灭火,反应的方程式为4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O,故答案为:4MgCO3·Mg(OH)2·5H2O
5MgO+4CO2↑+6H2O,故答案为:4MgCO3·Mg(OH)2·5H2O![]() 5MgO+4CO2↑+6H2O。
5MgO+4CO2↑+6H2O。


 寒假学与练系列答案
寒假学与练系列答案科目:高中化学 来源: 题型:
【题目】取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是( )
A. 苯与氢气反应生成环己烷
B. 甲烷与氯气反应制取CCl4
C. 乙炔使酸性KMnO4溶液褪色
D. 乙烯与溴反应生成1,2-二溴乙烷
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作中正确的是( )
A.过滤时,不可将悬浊液从烧杯中直接倒入漏斗中
B.蒸发操作时,应使混合物中的水分完全蒸干后,才能停止加热
C.分液操作时,现将分液漏斗中下层液体从下口放出,再将上层液体从下口放出
D.只要是液体混合物就可以用蒸馏来分离
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】手持技术的氧电化学传感器可用于测定O2含量.下图为某种氧电化学传感器的原理示意图,已知在测定O2含量过程中,电解质溶液的质量保持不变。一定时间内,若通过传感器的待测气体为a L(标准准状况),某电极增重了bg。下列说法正确的是
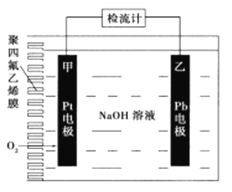
A. Pt上发生氧化反应 B. Pb上的电极反应式为4OH--4e-=O2↑+2H2O
C. 反应过程中转移OH-的物质的量为0.25bmol D. 待测气体中氧气的体积分数为0.7b/a
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,纯水中存在电离平衡:H2O![]() H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是( )
H++OH-。欲使水的电离平衡向正方向移动,并使c(H+)增大,应加入的物质是( )
A. H2SO4 B. AlCl3
C. NaHCO3 D. NaOH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. 钡中毒患者可尽快使用苏打溶液洗胃,随即导泻使Ba2+转化为BaCO3而排出
B. 工业上可以用NaHS、(NH4)2S等可溶性硫化物作沉淀剂除去废水中的Hg2+
C. 水中的Mg(HCO3)2、Ca(HCO3)2受热易分解生成难溶性的MgCO3、CaCO3,故水垢的主要成分是MgCO3、CaCO3
D. 珊瑚虫从周围海水中获取Ca2+和![]() ,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
,经反应形成石灰石(CaCO3)外壳,从而逐渐形成珊瑚
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应中H2O只做还原剂的是( )
A.2Na+2H2O═2NaOH+H2↑
B.2H2O═2H2↑+O2↑
C.2F2+2H2O═4HF+O2
D.CaO+H2O═Ca(OH)2
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com