
【题目】取代反应是有机化学中一类重要的反应,下列反应属于取代反应的是( )
A. 苯与氢气反应生成环己烷
B. 甲烷与氯气反应制取CCl4
C. 乙炔使酸性KMnO4溶液褪色
D. 乙烯与溴反应生成1,2-二溴乙烷
科目:高中化学 来源: 题型:
【题目】0.1mol由两种气态烃组成的混合气体完全燃烧后,得到0.16mol CO2和3.6克水,则混合气体中( )
A. 一定有甲烷
B. 一定是甲烷和乙烯
C. 可能有乙烷
D. 一定有乙炔
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是某硫酸试剂瓶的标签上的部分文字。据此,下列说法正确的是

A. 该试剂中加入适量蒸馏水可以获得较稀的硫酸溶液
B. 该试剂瓶的标签上应印有如图所示的警示标记

C. 该硫酸与等体积水混合所得溶液的物质的量浓度等于9.2mol/L
D. 在50mL量筒中配制0.1000mol/L硫酸溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于可逆反应N2(g)+3H2(g) ![]() 2NH3(g)ΔH<0,下列研究目的和示意图相符的是( )
2NH3(g)ΔH<0,下列研究目的和示意图相符的是( )
A | B | C | D | |
研究目的 | 压强对反应的影响(p2>p1) | 温度对反应的影响 | 平衡体系中增加N2浓度对反应的影响 | 催化剂对反应的影响 |
示意图 |
|
|
|
|
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际单位制的七个基本物理量之一B.二氧化碳的摩尔质量是44g/mol
C.标准状况下,22.4L水的物质的量是1molD.1mol氧气的质量是16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在体积均为1.0 L的两恒容密闭容器中加入足量的相同的碳粉,再分别加入0.1 mol CO2和0.2 mol CO2,在不同温度下反应 CO2(g)+C(s)![]() 2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是
2CO(g)达到平衡,平衡时CO2的物质的量浓度c(CO2)随温度的变化如图所示(图中Ⅰ、Ⅱ、Ⅲ点均处于曲线上)。下列说法正确的是

A. 反应 CO2(g)+C(s)![]() 2CO(g)的 ΔS>0、ΔH<0
2CO(g)的 ΔS>0、ΔH<0
B. 体系的总压强p总:p总(状态Ⅱ)<2p总(状态Ⅰ)
C. 体系中c(CO):c(CO,状态Ⅱ)<2c(CO,状态Ⅲ)
D. 逆反应速率v逆::v逆(状态Ⅰ)>v逆(状态Ⅲ)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫代硫酸钠(Na2S2O3)是一种重要的化工产品。某兴趣小组拟制备硫代硫酸钠晶体(Na2S2O3·5H2O)。
I.【查阅资料】
①硫代硫酸钠(Na2S2O3)易溶于水,在中性或碱性环境中稳定,受热、遇酸易分解。
②Na2S2O3·5H2O是无色透明晶体,易溶于水,其稀溶液与BaCl2溶液混合无沉淀生成。
③向Na2CO3和Na2S混合溶液中通人SO2可制得Na2S2O3(反应方程式为:![]() ,所得产品常含有少量Na2SO3和Na2SO4。
,所得产品常含有少量Na2SO3和Na2SO4。
Ⅱ.【制备产品】实验装置如图所示:
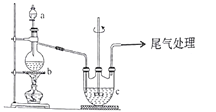
(1)实验步骤:检查装置气密性后,向三颈瓶c中加人Na2CO3和Na2S的混舍溶液,再将分液漏斗a中液体滴加到烧瓶b中加热发生反应产生SO2,请写出b中发生反应的化学方程式________。待Na2S和Na2CO3完全消耗后,结束反应。过滤c中的混合物,滤液经____(填操作名称)、过滤、洗涤、干燥、得到产品。
(2)为了保证硫代硫酸钠的产量,实验中通人的SO2不能过量,原因是_________。
III.【测定产品纯度】
称取10g产品(Na2S2O3·5H2O),配成250mL溶液,取25mL,以淀粉作指示剂,用0.1000mol/L碘的标准溶液滴定。反应原理为:![]() (忽略Na2SO3与I2反应)。
(忽略Na2SO3与I2反应)。
(3)滴定至终点的现象为:____。
(4)重复三次的实验数据如左下表所示,其中第三次读数时滴定管中起始和终点的液面位置如右下图所示,则x=___mL,产品的纯度为____。

IV.【探究与反思】
(5)为验证产品中含有Na2SO3和Na2SO4该小组设计了以下实验方案,请将方案补充完整(所需试剂从稀HN03、稀H2SO4、稀盐酸、蒸馏水中选择):取适量产品配成稀溶液,滴加足量BaCl2溶液,有白色沉淀生成,____,则可确定产品中含有Na2SO3和Na2SO4。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.氯化钠中混有少量单质碘杂质,可用升华的方法提纯
B.能使润湿的淀粉KI试纸变成蓝色的物质一定是Cl2
C.SO2可使酸性高锰酸钾溶液褪色,体现了SO2的漂白性
D.浓硫酸具有吸水性,可以用作干燥剂,例如可用于NH3的干燥
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氯碱工业的盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下:
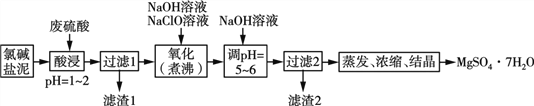
(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为___________________;滤渣1的主要成分为CaSO4和____(填化学式);为了提高浸取率可采取的措施有____(填字母)。
a. 多次用废硫酸浸取 b. 减小盐泥粒度并充分搅拌
c. 延长浸取时间 d.适当的提高酸浸的温度
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__________________;滤渣2为MnO2和____、____(填化学式)。
(3) 镁的碳化物常见的有MgC2和Mg2C3两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为________ 。
(4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理:____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com