
����Ŀ���ֳּ��������绯ѧ�����������ڲⶨO2����.��ͼΪij�����绯ѧ��������ԭ��ʾ��ͼ����֪�ڲⶨO2���������У��������Һ���������ֲ��䡣һ��ʱ���ڣ���ͨ���������Ĵ�������Ϊa L����״������ij�缫������bg������˵����ȷ����
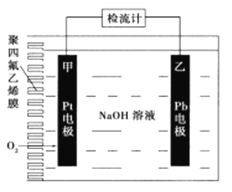
A. Pt�Ϸ���������Ӧ B. Pb�ϵĵ缫��ӦʽΪ4OH--4e-=O2��+2H2O
C. ��Ӧ������ת��OH-�����ʵ���Ϊ0.25bmol D. �����������������������Ϊ0.7b/a
���𰸡�D
������������װ��ͼ������֪���ó�Ϊԭ��أ�ͨ��������һ��Ϊ�������ҵ缫��Pb�缫Ϊ������A��Pt�缫ͨ������Ϊ������������ԭ��Ӧ��A����B��Pb�缫Ϊ������ʧȥ���ӷ���������Ӧ���缫����ʽΪ2Pb+4OH--4e-��2PbO+2H2O��B����C��Pb�缫Ϊ������ʧȥ���ӷ���������Ӧ���缫����ʽΪ2Pb+4OH--4e-��2PbO+2H2O�����4mol���������ӣ��缫��������32g���õ缫���ص�����Ϊbg����ת��OH-�����ʵ���Ϊ0.125bmol��C����D������C�ķ�����֪��ת�Ƶ������ʵ���Ϊ0.125bmol���ɵ缫����ʽΪO2+2H2O+4e-��4OH-���������������Ϊ22.4��0.125b/4L=0.7bL�����������������Ϊ0.7b/a��D��ȷ����ѡD��


 �Ķ��쳵ϵ�д�
�Ķ��쳵ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ʯ���ѻ�����ҪĿ����
A. �������Һ��ȼ�ϵIJ���
B. ���ڷ���
C. ������͵�����
D. ��ö�����������̬��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij����θ������ҩƬ��Ҫ�ɷ�Ϊ̼�����ƣ�Ϊ�ⶨҩƬ��̼�����Ƶĺ�������ҩƬ���飬ȡ4.0g��Ʒ���ȵ��������ټ���ʱ���ռ��������徭���������Ϊ0.88g����̼���������ȷֽ�Ļ�ѧ����ʽ��2NaHCO3![]() Na2CO3+H2O+CO2������Ʒ�������ɷ����Ȳ��ֽ⣩
Na2CO3+H2O+CO2������Ʒ�������ɷ����Ȳ��ֽ⣩
��1��̼�������ơ�̼��������Ԫ�ص�������������������ȣ���
��2���������Ʒ��̼�����Ƶ�����������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ij��Һ����Ba��NO3��2��Һ������������ϡHNO3�İ�ɫ����������Һ��һ������SO42��_______���ж϶Դ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������У��������Ӽ����й��ۼ�����
A. MgCl2 B. NH3 C. NH4Cl D. C2H2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ѧʵ���У���ʹijһ���е��к�������Ϊ��һ���ķ�Ӧ��γ�һ��ѭ�����Ͳ������ŷŸ����к����ʡ����磬���Ļ�����������ѭ����ϵ��

�����й�˵������ȷ����
A. ������Ӧ�ݣ�һ��Ҫ����������
B. ����������ֻ��Na2CrO4����������
C. �ӷ�Ӧ��������Cr(OH)3������CrCl3��NaOH��Ӧ����ȡ
D. ������Ӧ��ʱ������Na2Cr2O7����Ŀ��ת�Ƶĵ�����Ŀ֮��Ϊ1��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������л��������������ǣ� ��
A. 1��2��4�����ױ�
1��2��4�����ױ�
B.![]() 3������1����ϩ
3������1����ϩ
C.![]() 2������1������
2������1������
D.![]() 1��3���������
1��3���������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪ 25��C��101 kPa ʱ��2SO2(g)��O2(g) ![]() 2SO3(g)����H����197 kJ��mol-1�����ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ���ų�����ΪQ1������һ�������ͬ��������ͨ��1 mol SO2��0.5 mol O2 �ﵽƽ��ʱ�ų�����ΪQ2�������й�ϵ��ȷ����
2SO3(g)����H����197 kJ��mol-1�����ܱ�������ͨ��2 mol SO2��1 mol O2���ﵽƽ��ʱ���ų�����ΪQ1������һ�������ͬ��������ͨ��1 mol SO2��0.5 mol O2 �ﵽƽ��ʱ�ų�����ΪQ2�������й�ϵ��ȷ����
A. 2Q2<Q1<197 kJ B. Q2��Q1��197 kJ C. Q1<Q2<197 kJ D. 2Q2��Q1<197 kJ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ʵ�鼰�������Ƴ���Ӧ���۵���
ѡ�� | ʵ�� | ���� | ���� |
A | ��������ͭ�۵�Cu(NO3)2 ��Һ�е���ϡ���� | ͭ�����ܽ� | ϡ��������ͭ���ʷ�Ӧ |
B | ��H2O2��Һ�е����������Ը��������Һ | ���̲����������� | KMnO4��H2O2�ֽ�Ĵ��� |
C | ��ʢ��Ũ��ˮ����ƿ��ͨ���������������ȵIJ�˿����Һ���Ϸ� | ��˿���ֺ��ȣ���ƿ���а��̲��� | ���Ĵ�������ӦΪ���ȷ�Ӧ |
D | �������Ʒ���ȼ�ճ��У���ȼ�� Ѹ�����뼯��SO2�ļ���ƿ | ����������ɫ���̣���ƿ ���а�ɫ�������� | SO2���л�ԭ�� |
A. A B. B C. C D. D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com