
����Ŀ��������ʵ�鼰�������Ƴ���Ӧ���۵���
ѡ�� | ʵ�� | ���� | ���� |
A | ��������ͭ�۵�Cu(NO3)2 ��Һ�е���ϡ���� | ͭ�����ܽ� | ϡ��������ͭ���ʷ�Ӧ |
B | ��H2O2��Һ�е����������Ը��������Һ | ���̲����������� | KMnO4��H2O2�ֽ�Ĵ��� |
C | ��ʢ��Ũ��ˮ����ƿ��ͨ���������������ȵIJ�˿����Һ���Ϸ� | ��˿���ֺ��ȣ���ƿ���а��̲��� | ���Ĵ�������ӦΪ���ȷ�Ӧ |
D | �������Ʒ���ȼ�ճ��У���ȼ�� Ѹ�����뼯��SO2�ļ���ƿ | ����������ɫ���̣���ƿ ���а�ɫ�������� | SO2���л�ԭ�� |
A. A B. B C. C D. D
���𰸡�C
��������A����������ͭ�۵�Cu(NO3)2��Һ�е���ϡ���ᣬH����NO3�D���HNO3������ǿ�����ԣ���ϡ��������ͭ���ʷ�Ӧ���Ľ��۲���ȷ����A����B��KMnO4��H2O2��������������2KMnO4+5H2O2+3H2SO4![]() 2MnSO4+5O2��+K2SO4+8H2O����B����C��4NH3��5O2
2MnSO4+5O2��+K2SO4+8H2O����B����C��4NH3��5O2![]() 4NO��6H2O,��˿���ֺ��ȣ�˵�����Ĵ�������ӦΪ���ȷ�Ӧ����C��ȷ��D���������Ʒ���ȼ�ճ��У���ȼ��Ѹ�����뼯��SO2�ļ���ƿ��SO2���ϼ۽��ͣ��������ԣ���D����ѡC��
4NO��6H2O,��˿���ֺ��ȣ�˵�����Ĵ�������ӦΪ���ȷ�Ӧ����C��ȷ��D���������Ʒ���ȼ�ճ��У���ȼ��Ѹ�����뼯��SO2�ļ���ƿ��SO2���ϼ۽��ͣ��������ԣ���D����ѡC��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ֳּ��������绯ѧ�����������ڲⶨO2����.��ͼΪij�����绯ѧ��������ԭ��ʾ��ͼ����֪�ڲⶨO2���������У��������Һ���������ֲ��䡣һ��ʱ���ڣ���ͨ���������Ĵ�������Ϊa L����״������ij�缫������bg������˵����ȷ����
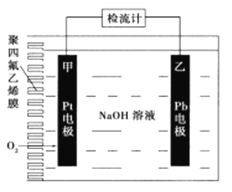
A. Pt�Ϸ���������Ӧ B. Pb�ϵĵ缫��ӦʽΪ4OH--4e-=O2��+2H2O
C. ��Ӧ������ת��OH-�����ʵ���Ϊ0.25bmol D. �����������������������Ϊ0.7b/a
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������仯��������������;�㷺��
I.����������ɰ�ķ���һ��þ��(��Ҫ�ɷ�ΪMgCO3��SiO2������������Fe2O3��MnO��CaO��)Ϊ��Ҫԭ����ȡ����̼��þ[MgCO3��Mg(OH)2��2H2O]�Ĺ�ҵ�������£�

(1)д�������ܡ�һ���У�MgCO3�����ᷴӦ�����ӷ���ʽ________________________��
(2)����2����Ҫ�ɷ���MnO2��______________��д������MnO2�����ӷ���ʽ___________________��
(3)���ϳɡ�ʱ��ͨ������80�������ȱ߽��裬�¶Ȳ��ܳ�80���ԭ����______________��
II.�Ӻ�ͭ�ḻ����Ȼ��Դ��ͭ��(CuFeS2)ұ��ͭ�Ĺ����������£�

��֪����CuFeS2+3CuCl2=4CuCl��+FeCl2+2S�� ��+1�۵�Cu���������������绯
(4)��ȡʱ��������FeCl3��Һ��Ҳ������CuCl��S���÷�Ӧ��ѧ����ʽΪ_________________��
(5)������1������Һ��ֻ��FeCl2�������ڿ����м������ɡ����պ����ù���Ļ�ѧʽΪ____________________��
(6)������Һ��pH������Cu�⣬���ܲ���һ�ֽ������ӣ��˽���������______________���������ӷ�����
(7)����3������Һ�е�CuCl2��ѭ��ʹ�ã�Ϊ�������̳���ѭ����ÿ����1molCu���������貹��CuCl2�����ʵ���Ϊ_______��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����4molA�����2molB������2L�������л�ϲ���һ�������·������·�Ӧ�� 2A(g)��B(g) ![]() 2C(g)������2s(��)����C��Ũ��Ϊ0.6mol��L-1�������м���˵����
2C(g)������2s(��)����C��Ũ��Ϊ0.6mol��L-1�������м���˵����
��������A��ʾ�ķ�Ӧ��ƽ������Ϊ0.3mol��L-1��S-1��������B��ʾ�ķ�Ӧ��ƽ������Ϊ0.6mol��L-1��S-1��2sʱ����A��ת����Ϊ70����2sʱ����B��Ũ��Ϊ0.7mol��L-1
������ȷ���ǣ� ��
A. �٢� B. �٢� C. �ڢ� D. �ۢ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������ȡ����ͭ��ʵ������У������������á���Ч���������������ѷ�����( )��
A. ͭ��Ũ���Ṳ��
B. ��ͭƬΪ������ʯīΪ���������ϡ����
C. �����շ�ͭм��������ͭ��Ȼ������Ũ�����ܽ�
D. �ʵ��¶��£�ʹͭƬ�ڳ���ͨ�������ϡ�������ܽ�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������йض����ԭ�ӵ���������ȷ����(����)
A. ��һ�������ԭ���У��������������˶�״̬��ȫ��ͬ�ĵ���
B. ��һ�������ԭ���У�������������������ͬ�ĵ���
C. ��һ�������ԭ���У�N���ϵĵ��������϶���M���ϵĵ���������
D. ij�������ԭ�ӵ�3p�ܼ��Ͻ����������ӣ����ǵ�����״̬��Ȼ�෴
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������¶���ڿ����У��ᷢ����ѧ��Ӧ������ɫ�仯����( )
A. NaClOB. NaOHC. Na2O2D. NaCl
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NAΪ����٤����������ֵ������˵���У���ȷ���ǣ� ��
A. ��״���£�22.4L Cl2��ȫ����ˮʱ��ת�Ƶĵ�����ΪNA
B. 16g���к��е�������ĿΪ10NA
C. ��״���£�2.24L NH3�к��еĹ��ۼ���ĿΪNA
D. �����£�23g NO2��N2O4�Ļ�������к���NA����ԭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���о�NO2��SO2��CO�ȴ�����Ⱦ����Ĵ���������Ҫ���塣
��1��NO2����ˮ���գ���Ӧ�Ļ�ѧ��Ӧ����ʽΪ____________________________________�����÷�Ӧ6NO2��8NH3![]() 7N2��12H2OҲ�ɴ���NO2����ת��1.2 mol����ʱ�����ĵ�NO2�ڱ�״������________L��
7N2��12H2OҲ�ɴ���NO2����ת��1.2 mol����ʱ�����ĵ�NO2�ڱ�״������________L��
��2����֪��ӦNO2(g)��SO2(g) ![]() SO3(g)��NO(g) ��H����41.8kJ��mol��1��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ�����������Ӧƽ��ʱNO2��SO2�������Ϊ1��6����ƽ�ⳣ��K��________��
SO3(g)��NO(g) ��H����41.8kJ��mol��1��һ�������£���NO2��SO2�������1��2�����ܱ������з���������Ӧ�����������Ӧƽ��ʱNO2��SO2�������Ϊ1��6����ƽ�ⳣ��K��________��
��3��CO�����ںϳɼ״�����Ӧ����ʽΪCO(g)��2H2(g) ![]() CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ���÷�Ӧ��H_____0(����������������)��ʵ����������������250����1.3��104 kPa���ң�ѡ���ѹǿ��������_______________________��
CH3OH(g)��CO�ڲ�ͬ�¶��µ�ƽ��ת������ѹǿ�Ĺ�ϵ��ͼ��ʾ���÷�Ӧ��H_____0(����������������)��ʵ����������������250����1.3��104 kPa���ң�ѡ���ѹǿ��������_______________________��

�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com