
【题目】1mol某烃最多可以和6molCl2发生取代反应,此烃分子中含有的氢原子数目为
A.6B.12C.3D.无法确定
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.摩尔是国际单位制的七个基本物理量之一B.二氧化碳的摩尔质量是44g/mol
C.标准状况下,22.4L水的物质的量是1molD.1mol氧气的质量是16g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于煤和石油综合利用的叙述中,正确的是 ( )
A.煤的气化是对其进行加热直接变为气体
B.煤的干馏和石油的分馏都是化学变化
C.石油产品裂解能生产乙烯
D.石油分馏的各馏分均是纯净物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2是危害最为严重的大气污染物之一,SO2的含量是衡量大气污染的一个重要指标。工业上常采用催化还原法或吸收法处理SO2。催化还原SO2不仅可以消除SO2污染,而且可得到有价值的单质S。
(1)在复合组分催化剂作用下,CH4可使SO2转化为S,同时生成CO2和H2O。已知CH4和S的燃烧热分别为890.3kJ/mol和297.2kJ/mol,CH4和SO2反应的热化学方程式为______________________。
(2)用H2还原SO2生成S的反应分两步完成,如图1所示,该过程中相关物质的物质的量浓度随时间的变化关系如图2所示:

①分析可知X为____________(写化学式),0~t1时间段的温度为_________,0~t1时间段用SO2表示的化学反应速率为________________________________。
②总反应的化学方程式为_______________________________。
(3)工业上可用Na2SO3溶液吸收SO2,该反应的离子方程式为__________________________,比较Na2SO3溶液中各离子浓度的大小关系为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学生用质量分数为98%、密度为1.84g/cm3的浓硫酸,配制0.2mol/L的硫酸溶液480mL.请回答下列问题:
(1)所需浓硫酸的体积为________mL(计算结果保留到小数点后1位)
(2)从下列用品中选出实验所需要的仪器__________(填序号).
A.1000mL烧杯B.100mL烧杯C.10mL量筒 D.100mL量筒E.500mL容量瓶.F.1000mL容量瓶 G.广口瓶H.托盘天平I.玻璃棒
除选用上述仪器外,尚缺少必要的仪器或用品是_____________.
(3)容量瓶在使用前必须进行的一步操作是______________________。
(4)该学生根据计算结果,进行如下实验操作:①用量筒量取计算所需体积的浓硫酸;
②向量筒中加入少量蒸馏水,并用玻璃棒搅拌;③立即将稀释后的溶液转入容量瓶中;④将蒸馏水直接注入容量瓶至刻度线;⑤把容量瓶盖盖紧,再振荡摇匀.
指出上述实验中错误的操作是______________(用编号表示).
(5)若实验中出现下列现象,造成所配溶液浓度偏高的有________。
a、浓硫酸稀释后未冷至室温即转移至容量瓶进行定容。
b、定容摇匀时,液面下降,再加水。
c、定容后,经振荡、摇匀、静置,液面下降。
d、定容时俯视刻度线。
e、定容时水加多了,用滴管吸出。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用氯碱工业的盐泥[含Mg(OH)2及少量的CaCO3、MnCO3、FeCO3、Al(OH)3、SiO2等]生产MgSO4·7H2O的工艺流程如下:
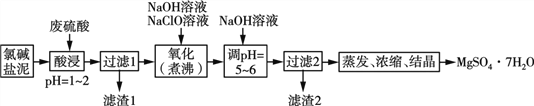
(1)酸浸时,FeCO3与硫酸反应的离子反应方程式为___________________;滤渣1的主要成分为CaSO4和____(填化学式);为了提高浸取率可采取的措施有____(填字母)。
a. 多次用废硫酸浸取 b. 减小盐泥粒度并充分搅拌
c. 延长浸取时间 d.适当的提高酸浸的温度
(2)氧化时,次氯酸钠溶液将MnSO4氧化为MnO2的离子方程式为__________________;滤渣2为MnO2和____、____(填化学式)。
(3) 镁的碳化物常见的有MgC2和Mg2C3两种,分别可发生水解反应生成乙炔和丙二烯,MgC2的电子式为________ 。
(4)一种碱式碳酸镁[4MgCO3·Mg(OH)2·5H2O]可用作防火保温材料,用化学方程式说明可作防火材料的原理:____________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:
2H2(g)+O2(g)===2H2O(l) ΔH=-571.6 kJ·mol-1
2CH3OH(l)+3O2(g)===2CO2(g)+4H2O(l)ΔH=-1452 kJ·mol-1
H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1
下列说法正确的是 ( )
A. H2(g)的燃烧热为571.6 kJ·mol-1
B. 同质量的H2(g)和CH3OH(l)完全燃烧,H2(g)放出的热量多
C. ![]() H2SO4(aq)+
H2SO4(aq)+![]() Ba(OH)2(aq)===
Ba(OH)2(aq)===![]() BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
BaSO4(s)+H2O(l) ΔH=-57.3 kJ·mol-1
D. 3H2(g)+CO2(g)=CH3OH(l)+H2O(l) ΔH=+135.9 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】阿立呱陛(A)是一种新的抗精神分裂症药物,可由化合物B,C,D 在有机溶剂中通过以下两条路线合成得到。
A: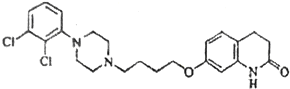
B: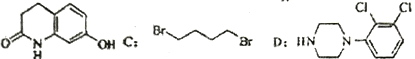
线路一:![]()
线路二:![]()
(1)E的结构简式为______________,其含氧官能团有_________(写名称)。
(2)由C,D 生成化合物F 的反应类型是_____________。化合物C与足量的NaOH乙醇溶液共热反应的产物的名称是_________________。
(3)H 属于氨基酸,与B 的水解产物互为同分异构体。H 能与FeCl3溶液发生显色反应,且苯环上的一氯代物只有2 种。写出一种满足上述条件的H 的结构简式_________________。
(4)合成F (相对分子质量为366) 时还可能生成一种相对分子质量为285 的副产物G,G 能使溴水褪色,G 的结构简式为_________________。
(5)已知: 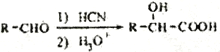 写出由C制备
写出由C制备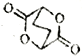 的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
的合成路线流程图(无机试剂任选)。合成路线流程图示例如下:
 _____________________
_____________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CO、CO2是化石燃料燃烧的主要产物。
(1)将含002molCO2和001molCO的混合气体通入有足量Na2O2固体的密闭容器中,同时不断地用电火花点燃,充分反应后,固体质量增加______g。
(2)已知:2CO(g)+O2(g)=2CO2(g) △H=-566.0kJ/mol,键能Eo-o=499.0kJ/mol。
①反应:CO(g)+O2(g)![]() CO2(g)+O(g)的△H=______kJ/mol。
CO2(g)+O(g)的△H=______kJ/mol。
②已知2500K时,①中反应的平衡常数为0.40,某时刻该反应体系中各物质浓度满足:c(CO)·c(O2)=c(CO2) ·c(O),则此时v(正)_____(填“>""<"或"=”)v(逆)。
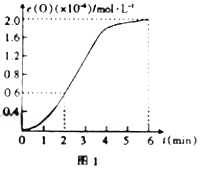
③已知1500℃时,在密闭容器中发生反应:CO2(g)![]() CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
CO(g)+O(g)。反应过程中O(g)的物质的量浓度随时间的变化如图1所示,则0~2min内,CO2的平均反应速率v(CO2)=______。
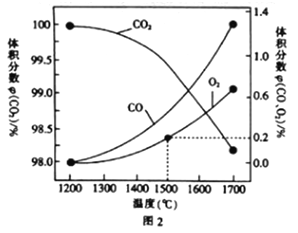
(3)在某密闭容器中发生反应:2CO2(g)![]() 2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
2CO(g)+O2(g),1molCO2在不同温度下的平衡分解量如图2所示。
①恒温恒容条件下,能表示该可逆反应达到平衡状态的有___(填字母).
A.CO的体积分数保持不变
B.容器内混合气体的密度保持不变
C.容器内混合气体的平均摩尔质量保持不变
D.单位时间内,消耗CO的浓度等于生成CO2的浓度
②分析图2,若1500℃时反应达到平衡状态,且容器体积为1L,则此时反应的平衡常数K=____(计算结果保留1位小数)。
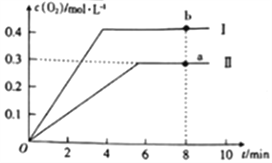
③向2L的恒容密闭容器中充入2molCO2(g),发生反应:2CO2(g)![]() 2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
2CO(g)+O2(g),测得温度为T℃时,容器内O2的物质的量浓度随时间的变化如曲线II所示。图中曲线I表示相对于曲线II仅改变一种反应条件后c(O2)随时间的变化,则改变的条件是______;a、b两点用CO浓度变化表示的净反应速率关系为va(CO)_____(填“>”“<”或“=”)vb(CO)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com