
【题目】爱国实业家侯德榜在氨碱法的基础上,发明了“联合制碱法”,简单流程如图。完成下列问题:
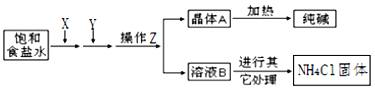
(1)在饱和食盐水中通入X和Y,则X______和Y_______(填物质名称),先通X后通Y的原因是_______________________。
(2)写出通入X和Y的化学反应方程式____________________________。
(3)操作Z包括________和________(填名称)。
(4)溶液B中含有的主要离子是_____________,为了得到化肥(NH4Cl),需要在溶液B中通入NH3、冷冻、加食盐,其中通入NH3的作用一_______________________________,作用二_______________________________。
(5)工业生产的纯碱常会含少量NaCl杂质。现用重量法测定其纯度,步骤如下:
① 称取样品ag,加水溶解;
② 加入足量的BaCl2溶液;
③ 过滤、_________、烘干、冷却、称量、烘干、冷却、_________,最终得到固体bg。样品中纯碱的质量分数为___________________(用含a、b的代数式表示)。
【答案】 氨气 二氧化碳 氨气在水中溶解度大,先通氨气有利于生成碳酸氢钠沉淀 NaCl + NH3+CO2 +H2O → NaHCO3↓+NH4Cl 过滤 洗涤 Na+、HCO3-、NH4+、Cl- 将NaHCO3转化为Na2CO3 产生的NH4+有利于NH4Cl形成 洗涤 (再)称量 106 b/197a
【解析】(1)以食盐、氨和二氧化碳为原料来制取纯碱,氨气极易溶于水,先把氨气通入饱和食盐水中先形成碱性的盐溶液,然后通入二氧化碳气体,其水溶液显酸性,酸碱易发生中和反应,有利于碳酸氢钠沉淀,所以先通氨气,后通二氧化碳;正确答案:氨气 二氧化碳;氨气在水中溶解度大,先通氨气有利于生成碳酸氢钠沉淀。
(2)食盐水中通入氨气和二氧化碳后发生反应生成碳酸氢钠和氯化铵,化学反应方程式:NaCl + NH3+CO2 +H2O → NaHCO3↓+NH4Cl;正确答案:NaCl + NH3+CO2 +H2O → NaHCO3↓+NH4Cl。
(3)分离固体和液体,进行过滤操作,再洗涤固体;所以操作Z包括过滤和洗涤;正确答案:过滤和洗涤。
4)经过过滤后,滤液中含有氯化铵及少量碳酸氢钠,因此溶液B中含有的主要离子是Na+、HCO3-、NH4+、Cl- ;为了得到化肥(NH4Cl),需要在溶液B中通入NH3、冷冻、加食盐,由于氨水显碱性,就会将NaHCO3转化为Na2CO3,反应产生的NH4+有利于NH4Cl形成;正确答案:Na+、HCO3-、NH4+、Cl- ;将NaHCO3转化为Na2CO3 ; 产生的NH4+有利于NH4Cl形成 。
(5)加入足量的![]() 溶液发生反应:
溶液发生反应:![]() ↓
↓![]() ,
,![]() ,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,再称量所得固体,最终得到固体
,根据原子守恒,通过称量沉淀碳酸钡的质量,来计算样品中纯碱的质量分数,需洗涤沉淀,除去杂质离子,且将沉淀冷却到室温,再称量所得固体,最终得到固体![]() 为
为![]() ,根据碳守恒,纯碱的质量分数
,根据碳守恒,纯碱的质量分数![]() ;正确答案:洗涤;称量;
;正确答案:洗涤;称量;![]() 。
。


科目:高中化学 来源: 题型:
【题目】下列关于糖类水解产物或水解过程的叙述中正确的是
A. 所有的糖类都能发生水解反应生成单糖
B. 蔗糖与麦芽糖的水解产物相同
C. 淀粉在人体内直接水解成葡萄糖
D. 在酸的催化作用下,淀粉和纤维素都可以水解成葡萄糖
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化铈(CeO2)是一种重要的稀土化合物。以氟碳铈矿(主要含CeCO3F)为原料制备CeO2的一种工艺流程如下:
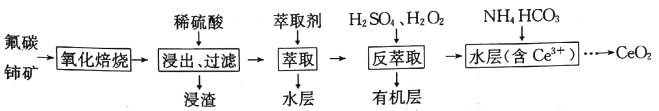 已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
已知:i.Ce4+能与Fˉ结合成[CeFx](4-x)+,也能与SO42-结合成[CeSO4]2+;
ⅱ.在硫酸体系中Ce4+能被萃取剂[(HA)2]萃取,而Ce3+不能
ⅲ.常温下,Ce2(CO3)3饱和溶液浓度为1.0×10-6mol·L-1。
回答下列问题:
(1)“氧化焙烧”过程中可以加快反应速率和提高原料利用率的方法是__________、__________ (写出2种即可)。
(2)写出“氧化焙烧”产物CeO2与稀H2SO4反应的离子方程式:__________。
(3)“萃取”时存在反应:Ce4++n(HA)2![]() Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=
Ce(H2n-4A2n)+4H+。D表示Ce4+分别在有机层中与水层中存在形式的浓度之比(D=![]() )。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
)。保持其它条件不变,在起始料液中加入不同量的Na2SO4以改变水层中的c(SO42-),D随起始料液中c(SO42-)增大而减小的原因是_____________。
(4)浸渣经处理可得Ce(BF4)3,加入KCl溶液发生如下反应:
Ce(BF4)3(s)+ 3K+(aq) ![]() 3KBF4(s)+ Ce3+(aq)。
3KBF4(s)+ Ce3+(aq)。
若一定温度时,Ce(BF4)3、KBF4的Ksp分别为a、b,则该反应的平衡常数K=__________(用a、b表示)。
(5)“反萃取”中加H2O2的主要反应离子方程式为__________。在“反萃取”后所得水层中加入1.0mol·L-1的NH4HCO3溶液,产生Ce2(CO3)3沉淀,当Ce3+沉淀完全时[c(Ce3+)=1×10-5mol·L-1],溶液中c(CO32-)约为__________。
(6)CeO2是汽车尾气净化催化剂的关键成分,它能在还原气氛中供氧,在氧化气氛中耗氧。在尾气消除过程中发生着CeO2![]() CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
CeO2(1-x)+xO2↑(0≤x≤0.25)的循环。写出CeO2消除CO尾气的化学方程式:___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. 1 mol H2SO4 的质量为98 g·mol-1 B. 常温常压下11.2LCO2所含分子数为0.5NA
C. H2SO4 的摩尔质量为98 g D. 6.02×1022个H2SO4分子的质量为9.8 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮的单质及其化合物性质多样,用途广泛。完成下列填空:
(1)用催化技术将汽车尾气中的NO和CO转变成CO2和N2,反应原理为:2NO(g)+2CO(g)![]() 2CO2(g)+N2 (g) +Q
2CO2(g)+N2 (g) +Q
某温度下测得该反应在不同时间的CO浓度如下表:
时间(s) 浓度 ×10-3(molL-1) | 0 | 1 | 2 | 3 | 4 | 5 |
c(CO) | 3.60 | 3.05 | 2.85 | 2.75 | 2.70 | 2.70 |
该反应平衡常数K的表达式____________________;温度升高,K值___________(选填“增大”、“减小”、“不变”);前2s内的平均反应速率v(N2)=_______________;若上述反应在密闭容器中发生,达到平衡时能提高NO转化率的措施之一是_________。
(2)工业合成氨的反应温度选择500℃左右的主要原因是______________________。
(3)在固定容积的密闭容器中,加入1mol氮气和3mol氢气模拟工业合成氨,反应在一定条件下已达到平衡的标志是__________________________________________________。
(4)常温下向含1mol溶质的稀盐酸中缓缓通入1molNH3(溶液体积变化忽略不计),反应结束后溶液呈现酸性的原因________________________________(用离子方程式表示);在通入NH3的过程中溶液的导电能力______(选填“变大”、“变小”、“几乎不变”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硼和氮的单质及一些化合物在工农业生产等领域有重要应用。回答下列问题:
(1)N原子核外有___ 种不同运动状态的电子。基态N原子中,能量最高的电子所占据的原子轨道的形状为____________________________。
(2)经测定发现,N2O5固体由NO2+ 和NO3-两种离子组成,该固体中N原子杂化类型为_________;与NO2+互为等电子体的微粒有_______(写出一种)。
(3)HF和HI电离出H+较难的是________(填化学式,下同)。铵盐大多不稳定,请预测NH4F、NH4I中,较易分解的是________。
(4)第二周期中,第一电离能介于B元素和N元素间的元素为_____(填“元素符号”)。
(5)晶体硼有多种变体,但其基本结构单元都是由硼原子组成的正二十面体( 见图I),每个顶点为一个硼原子,每个三角形均为等边三角形。则每一个此基本结构单元由_______个硼原子构成;若该结构单元中有2 个原子为10B(其余为11B),那么该结构单元有_____种不同类型。
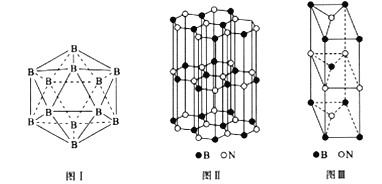
(6)硼和氮构成的一种氮化硼晶体的结构与石墨晶体结构相类似,B、N原子相互交替排列(见图II),其晶胞结构如图III所示。该晶胞有_____个B和_____个N。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各数值表示有关元素的原子序数,其所表示的各原子组中能相互结合成AB2型稳定共价化合物的是( )
A.18和12
B.7和8
C.11和16
D.12和9
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有四种元素的基态原子的电子排布式如下:①1s22s22p63s23p2;②1s22s22p63s23p3;③1s22s22p4;④1s22s22p3。则下列有关比较中正确的是( )
A. 电负性:④>③>②>①
B. 原子半径:③>④>②>①
C. 第一电离能:④>③>②>①
D. 最高正化合价:③>④=②>①
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各选项中,各类物质依次表示为X、Y、Z,其中与图中三个圆所示的从属关系不相符的是:

A. 氧化物、化合物、纯净物
B. 碱性氧化物、金属氧化物、氧化物
C. 胶体、分散系、混合物
D. 复分解反应、置换反应、化学反应
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com