
【题目】聚合氯化铝是一种新型净水剂,其中铝的总浓度(用c表示)包括三类:主要为Al3+中的单体形态铝(用Ala表示)总浓度,主要为 [AlO4Al12(OH)24(H2O)12]7+的中等聚合形态铝总浓度(用Alb表示)和Al(OH)3胶体形态铝(用Alc表示)总浓度。
(1)真空碳热还原一氧化法可实现由铝土矿制备金属铝,相关反应的热化学方程式如下:
①Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g) ΔH1=akJ·mol-1
②6AlCl(g)=4Al(s)+2AlCl3(g) ΔH2=bkJ·mol-1
则反应Al2O3(s) +3C(s)=2Al (s)+3CO(g) 说明ΔH=_______kJ·mol-1(用含a、b的代数式表示)。
_0( 填“>”或“<”)。
反应①在常压、1900℃的高温下才能进行,说明ΔH_______0(填“>”、“<”或“=”)
(2)用膜蒸馏(简称MD)浓缩技术将聚合氯化铝溶液进行浓缩,实验过程中不同浓度聚合氯化铝溶液中铝形态分布(百分数)如右表:
AlT/(mol·L-1) | Ala/% | Alb/% | A1c/% |
0.208 | 1.4 | 86.6 | 12.0 |
0.489 | 2.3 | 86.2 | 11.5 |
0.884 | 2.3 | 88.1 | 9.6 |
1.613 | 3.1 | 87.0 | 9.9 |
2.520 | 4.5 | 88.2 | 7.3 |
①在一定温度下,AlT越大,Al(OH)3胶体的百分含量________(填“越大”“越小”或“不变”)。
②若将c=2.520mol/L的聚合氧化铝溶液加水稀释,则稀释过程中发生的主要反应的离子方程式为_________________________________。
(3)一定条件下,向1.0mol/L的AlCl溶液中加入0.6mol/L的NaOH溶液,可制得Alb含量约为86% 的聚合氯化铝溶液。写出生成[AlO4Al12(OH)24(H2O)12]7+的离子方程式:_________________________。
(4)已知Al3++4X![]() 2
2![]() ,X表示显色剂,
,X表示显色剂,![]() 表示有色物质,通过比色分析得
表示有色物质,通过比色分析得
到25 ℃时Al3+浓度随时间的变化关系如图所示(初始时X的浓度为0.194 mol·L-1)。
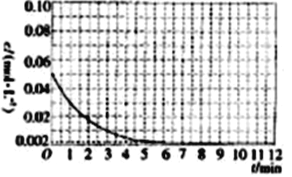
①1min时, ![]() 的浓度为___________。
的浓度为___________。
②0~3min内该反应的速率vx=________。
③第9min时,反应达到平衡,K=__________(用代数式表示)。
【答案】 a+0.5b > 越小 Al3++3H2O=Al(OH)3(胶体)+3H+ 13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+ 0.04mol/L 0.053mol/(L·min) K=(9.6×10-2)2/(2×10-3)5
【解析】(1)化学方程式①+化学方程式②/2,即可得到Al2O3(s) +3C(s)=2Al (s)+3CO(g),所以ΔH=ΔH1+ΔH2/2= a+0.5b;Al2O3(s)+AlCl3(g)+3C(s)=3AlCl(g)+3CO(g)是熵增加的反应,根据吉布斯自由能ΔG=ΔH-TΔS,可知反应在较高温度下才能自发进行时的 ΔH>0。
(2)①由表格数据可知,在一定温度下,AlT越大,Al(OH)3胶体的百分含量越小。
②由实验数据可知稀释时,Al3+浓度减小,Al(OH)3浓度增加,所以发生的主要反应为:Al3++3H2O=Al(OH)3(胶体)+3H+。
(3)Al3+和OH-在水溶液中生成[AlO4Al12(OH)24(H2O)12]7+,根据原子守恒和电荷守恒可写出对应的离子方程式为:13Al3++32OH-+8H2O=[AlO4Al12(OH)24(H2O)12]7+。
(4)①1分钟内Al3+的浓度减少0.02mol/L,根据方程式可知1min时![]() 的浓度为0.02mol/L×2=0.04mol/L。
的浓度为0.02mol/L×2=0.04mol/L。
②0~3min内Al3+的反应速率v=(0.05-0.01)÷3=![]() mol/(L·min),所以v(X)=
mol/(L·min),所以v(X)= ![]() mol/(L·min)×4=0.053mol/(L·min)。
mol/(L·min)×4=0.053mol/(L·min)。
③反应达平衡时,Al3+的浓度减少0.048mol/L,则X的浓度减少0.192mol/L,![]() 的浓度增大0.096mol/L,所以平衡时Al3+的浓度为0.002mol/L,X的浓度为0.002mol/L,
的浓度增大0.096mol/L,所以平衡时Al3+的浓度为0.002mol/L,X的浓度为0.002mol/L,![]() 的浓度为0.096mol/L,故K=(9.6×10-2)2/(2×10-3)5。
的浓度为0.096mol/L,故K=(9.6×10-2)2/(2×10-3)5。


 期末集结号系列答案
期末集结号系列答案科目:高中化学 来源: 题型:
【题目】如图表示构成细胞的元素、化合物,a、b、c、d代表不同的小分子物质,A、B、C代表不同的大分子物质,据图分析不正确的是( )

A. 若物质A是动、植物细胞中均含有的储能物质,则A是脂肪
B. 物质b是氨基酸,若某种B分子由n个b分子(平均相对分子质量为m)组成的2条链组成,则该B分子的相对分子质量大约为mn﹣18(n﹣2)
C. 物质c在人体细胞中共有5种,分子中的含氮碱基不同决定了c的种类不同
D. 物质d是性激素,d和胆固醇、维生素D都属于固醇类物质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某实验小组同学依据资料深入探究Fe3+在水溶液中的行为。
资料:
ⅰ.Fe3+在水溶液中以水合铁离子的形式存在,如[Fe(H2O)6]3+;[Fe(H2O)6]3+发生如下水解反应:
[Fe(H2O)6]3+(几乎无色)+nH2O![]() [Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
[Fe(H2O)6-n(OH)n]3-n(黄色)+nH3O+(n=0~6);
ⅱ.[FeCl4(H2O)2]-为黄色。
进行实验:
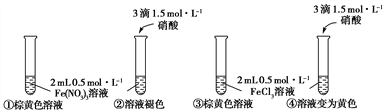
【实验Ⅰ】
【实验Ⅱ】
分别用试管①、③中的试剂作为待测液,用色度计测定其透光率。透光率越小,溶液颜色越深;透光率越大,溶液颜色越浅。
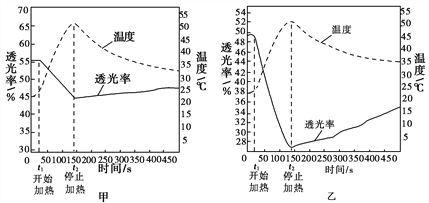
Fe(NO3)3溶液透光率随温度变化曲线 FeCl3溶液透光率随温度变化曲线
(1)实验Ⅰ中,试管②溶液褪色的原因是_________________________________________。
(2)实验Ⅰ中,试管③溶液呈棕黄色与[FeCl4(H2O)2]-有关,支持此结论的实验现象是_____________________________________________________________________________。
(3)由实验Ⅱ图甲、乙可知:加热时,溶液颜色________(填“变浅”“变深”或“不变”)。
(4)由实验Ⅱ,可以得出如下结论:
【结论一】FeCl3溶液中存在可逆反应:[FeCl4(H2O)2]-+4H2O![]() [Fe(H2O)6]3++4Cl-得出此结论的理由是_______________________________________________________。
[Fe(H2O)6]3++4Cl-得出此结论的理由是_______________________________________________________。
【结论二】结论一中反应的ΔH________(填“>0”或“<0”)。
(5)实验小组同学重新设计了一个实验证明(4)中结论一。实验方案:取试管①中溶液,_______________________(请描述必要的实验操作和现象)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法中正确的是( )
A. AlCl3溶液和Al2(SO4)3溶液加热,蒸发,浓缩结晶,灼烧,所得固体的成分相同
B. 配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,后再加水稀释到所需的浓度
C. 向CuCl2溶液中加入CuO,调节pH可除去溶液中混有的Fe3+
D. 泡沫灭火器中常使用的原料是Na2CO3和Al2(SO4)3
查看答案和解析>>
科目:高中化学 来源: 题型:
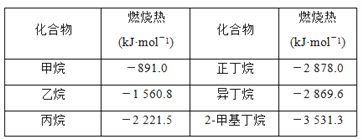
【题目】一些烷烃的燃烧热如下表:
下列说法正确的是( )
A. 正戊烷的燃烧热大约是-3 540 kJ·mol-1
B. 热稳定性:正丁烷>异丁烷
C. 乙烷燃烧的热化学方程式为2C2H6(g)+7O2(g)=4CO2(g)+6H2O(g) ΔH=-1 560.8 kJ·mol-1
D. 相同质量的烷烃,碳的质量分数越大,燃烧放出的热量越多
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用98%的浓H2SO4(ρ=1.84g/ml)配制 1mol/L的稀硫酸100mL,按配制溶液时仪器的选用顺序排列,选择正确的是( )
① 玻璃棒 ② 胶头滴管 ③ 100mL容量瓶 ④ 托盘天平 ⑤ 50mL烧杯 ⑥10mL量筒
⑦ 100mL量筒 ⑧ 移液管 ⑨ 滴定管
A.⑥③⑧⑤①② B.⑥⑤③①⑨② C.④⑤③②①⑨ D.⑥⑤①③②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.某兴趣小组设计用铁粉将NO还原为N2(同时生成FeO)。

已知:①浓硝酸可氧化NO;②NaOH溶液能吸收NO2,不吸收NO。
(1)装置A中反应的离子方程式是_________________________________________。
(2)装置的连接顺序为:a→()→()→()→()→()→()→()→()→d
Ⅱ.已知:硫酰氯通常条件下为无色液体,熔点为-54.1℃,沸点为69.1℃,易水解产生大量白雾;易分解:SO2Cl2=SO2↑+Cl2↑,催化合成硫酰氯的实验装置如下图(夹持装置已省略)
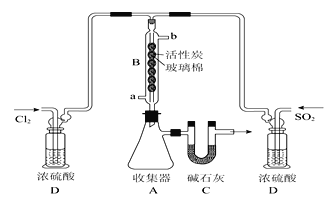
回答下列问题:
(3)仪器B的名称是____________仪器B冷却水的进口为_______(填“a”或“b”)活性炭的作用是_______________________。
(4)装置D除干燥气体外,另一个作用是__________________。若缺少D,则硫酰氯会水解,该反应的化学方程式是_________________________________。
(5)C装置的作用是________________。为了防止硫酰氯分解,某同学建议将收集器A放在__________中冷却。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氧是地壳中含量最多的元素。
(1)氧元素基态原子核外未成对电子数为________个。
(2)H2O分子内的O—H键、分子间的范德华力和氢键从强到弱依次为________。![]() 的沸点比
的沸点比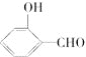 高,原因是__________________________。
高,原因是__________________________。
(3)H+可与H2O形成H3O+,H3O+中O原子采用________杂化。H3O+中H—O—H键角比H2O中H—O—H键角大,原因为_____________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com