
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。其中,控制空气中氮氧化物和硫氧化物的含量尤为重要。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H=+67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0kJ/mol
则CH4催化还原NO的热化学方程式为_______。
(2)将0.20mol NO和0.10mol CO充入一个温度恒定、容积恒为2L的密闭容器中发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现氮氧化物的转化,反应过程中部分物质的物质的量变化如图所示。
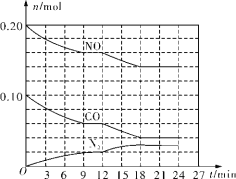
①N2在0~9min内的平均反应速率v(N2)=________mol/(L·min)(保留两位有效数字)。
②第12min时改变的反应条件可能为________(填字母代号)。
a.充入水蒸气稀释反应物 b.加入NO c.加催化剂 d.增大压强
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): ___________
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+) =c(SO32-)+c(HSO3-)+c(OH-)
【答案】CH4 (g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g) △H=-977.2KJ·mol-1 1.1×10-3 D 2.2 ab
【解析】
(1)①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H= +67.8 kJ/mol;
③N2(g)+O2(g)=2NO(g) △H= +89.0 kJ/mol;
盖斯定律计算①+②-③×2得到CH4催化还原NO的热化学方程式。
(2)①图象分析可知N2 浓度变化为0.01mol·L-1,反应速率v=△c÷△t计算;
②图象分析判断12min后反应物浓度增大,生成物浓度减小,说明平衡逆向进行,反应是放热反应,升温改变符合图象变化;
②图象分析可知12min后一氧化氮和一氧化碳浓度降低,氮气浓度增大,物质的量的变化量比等于方程式的计量数之比,说明平衡正向进行,反应是气体体积减小的反应,加压平衡正向进行,符合图象变化。
(3)利用溶液中存在的电荷守恒分析;
(4)①a、利用物料守恒分析;
b、当n(SO32-):n(HSO3-)=1:1时,PH为7.2,故当为中性时,n(SO32-)要减少,故c(HSO3-)>c(SO32-);
c、电荷守恒为:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故c错误;
故答案为:ab;
(1)①CH4(g)+ 2NO2(g)= N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)= 2NO2(g) △H= +67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H= +89.0kJ/mol
盖斯定律计算①+②-③×2得到CH4催化还原NO的热化学方程式:
CH4(g)+4NO(g)═2N2(g)+CO2(g)+2H2O(g) △H= -977.2kJ·mol-1
(2)①反应从开始到9min时,图象分析可知氮气浓度变化为0.02mol÷2L=0.01mol·L-1,N2在0~9min内的平均反应速率v(N2)=![]() =1.1×10-3mol·L-1·min-1;
=1.1×10-3mol·L-1·min-1;
②a.充入水蒸气稀释反应物平衡不移动,故a不符;
b.加入NO后浓度应增大,故b不符;
c.加催化剂不影响平衡,故c不符;
d.增大压强,2NO(g)+2CO(g)=N2(g)+2CO2 (g),图象分析可知12min后一氧化氮和一氧化碳浓度降低,氮气浓度增大,物质的量的变化量比等于方程式的计量数之比,说明平衡正向进行,反应是气体体积减小的反应,加压平衡正向进行,符合图象变化,故d符合;
故选d;
(3)烟气中的SO2可用某浓度NaOH溶液吸收得到Na2SO3和NaHSO3混合溶液,且所得溶液呈中性,依据溶液中电荷守恒分析,c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),c(H+)=c(OH-),得到(Na+)=2c(SO32-)+c(HSO3-),中![]() =
=![]() =
=![]() +1=2.2;
+1=2.2;
(4)①a、利用物料守恒可知a正确;
b、当n(SO32-):n
c、电荷守恒为:c(Na+)+c(H+)=2c(SO32-)+c(HSO3-)+c(OH-),故c错误;
故答案为:ab。


科目:高中化学 来源: 题型:
【题目】硫酸锰是重要的微量元素肥料之一,易溶于水,难溶于乙醇。工业上用软锰矿(主要成分是MnO2,含有少量Fe2O3、Al2O3、MgO、SiO2)通过如下简化流程既可脱除燃煤尾气中的SO2,又能制备硫酸锰晶体,实现了资源的综合利用:
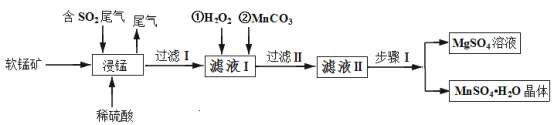
请回答下列问题:
(1)上述流程中第一步浸锰脱硫的好处是_________(答出一点即可)。
(2)写出浸锰过程中软锰矿中的MnO2发生的化学方程式_________。
(3)通过实验如何判定滤液Ⅰ中已加入足量H2O2 __________;加MnCO3的目的是调节溶液的pH,使滤液Ⅰ中的相关离子形成沉淀而除去,请写出 “过滤 Ⅱ”中所得滤渣的主要成分有________。
(4)已知硫酸锰晶体和硫酸镁晶体的溶解度曲线如图所示。
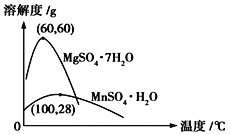
请写出步骤Ⅰ操作_________、趁热过滤;为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的________(填选项字母)进行洗涤,实验效果最佳。
A 乙醇 B 饱和K2SO4溶液 C 蒸馏水 D 乙醇水溶液
(5)滤液Ⅱ还可通过加入过量NH4HCO3进行“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_________。“50℃碳化”可能的原因是:_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。下图是某同学用0.1mol/L KOH 溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH 溶液滴定曲线示意图(混合溶液体积变化忽略不计)。下列有关判断不正确的是
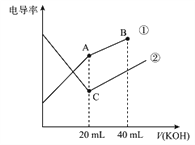
A. 曲线①代表0.1mol/L KOH 溶液滴定CH3COOH溶液的滴定曲线,曲线②代0.1mol/LKOH 溶液滴定HCl溶液的滴定曲线
B. 在相同温度下,C点水电离的c (H+) 大于A点水电离的c(H+)
C. 在A 点的溶液中有: c(CH3COO-)+c(OH-)-c (H+)=0.05mol/L
D. 在B 点的溶液中有: c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,用0.1000mol/L的NaOH溶液滴定某浓度的二元弱酸(![]() )溶液,所得溶液中各种含X的微粒的物质的量分数(
)溶液,所得溶液中各种含X的微粒的物质的量分数(![]() )与pH的变化曲线如图所示。下列说法正确的是
)与pH的变化曲线如图所示。下列说法正确的是

A. ![]() 的电离常数
的电离常数![]() ,
, ![]() 的水解常数
的水解常数![]()
B. 由水电离出的c(![]() ):a>b
):a>b
C. 曲线![]() 分别表示
分别表示![]() (
(![]() )和
)和![]() (HX-)的变化
(HX-)的变化
D. b点所示溶液中:c(![]() >3c(
>3c(![]() )
)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是( )
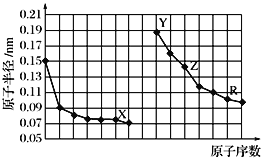
A. Z和R所形成的化合物,不能通过溶液中复分解反应而制得
B. 简单离子的半径关系是:R>Y>Z>X
C. X和Y所形成的一种化合物,可用于自来水消毒
D. 工业上获得单质Z的方法,一般是通过电解其熔融氯化物来实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是
A. 3.2g铜溶于过量的浓硝酸完全反应生成的气体的物质的量一定为0.1mol
B. 78gNa2S和Na2O2的混合物中阳离子与阴离子的个数比不能确定
C. 25℃HCN的电离平衡常数为5.0×10-10,则浓度均为0.10mol·L-1NaCN和HCN的混合溶液中有c(Na+)>c(CN-)>c(OH-) >c(H+)
D. Fe(NO3)2溶液中加入过量的HI溶液:Fe2++NO3-+4H++2I-=I2+Fe3++NO↑+2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表。有一种非常有趣的钟表式周期表如图所示,下列说法正确的是( )

A.12:00时“时针”所指元素的金属性最强
B.从中午12:00点到晚上23:00点,“时针”所指元素的金属性依次减弱
C.9:55时“时针”和“分针”所指的两种元素(“针”所指以最近为准)形成的化合物中阴、阳离子之比为1:1
D.2:00时,“时针”和“分针”所指的元素的原子最外层均只有两个电子,性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物的摩尔质量为17g/mol;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是
。下列说法正确的是
A.XZ2、M2Z2均为共价化合物
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质硬度一定很大
D.由X、Y、Z、M四种元素形成的化合物只含有离子键
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com