
【题目】硫酸锰是重要的微量元素肥料之一,易溶于水,难溶于乙醇。工业上用软锰矿(主要成分是MnO2,含有少量Fe2O3、Al2O3、MgO、SiO2)通过如下简化流程既可脱除燃煤尾气中的SO2,又能制备硫酸锰晶体,实现了资源的综合利用:
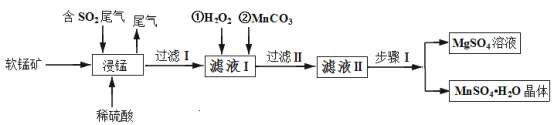
请回答下列问题:
(1)上述流程中第一步浸锰脱硫的好处是_________(答出一点即可)。
(2)写出浸锰过程中软锰矿中的MnO2发生的化学方程式_________。
(3)通过实验如何判定滤液Ⅰ中已加入足量H2O2 __________;加MnCO3的目的是调节溶液的pH,使滤液Ⅰ中的相关离子形成沉淀而除去,请写出 “过滤 Ⅱ”中所得滤渣的主要成分有________。
(4)已知硫酸锰晶体和硫酸镁晶体的溶解度曲线如图所示。
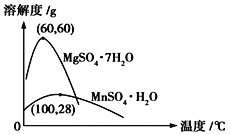
请写出步骤Ⅰ操作_________、趁热过滤;为了保证产品的纯度,同时又减少产品的损失,应选择下列溶液中的________(填选项字母)进行洗涤,实验效果最佳。
A 乙醇 B 饱和K2SO4溶液 C 蒸馏水 D 乙醇水溶液
(5)滤液Ⅱ还可通过加入过量NH4HCO3进行“50℃碳化”得到高纯碳酸锰,反应的离子方程式为_________。“50℃碳化”可能的原因是:_________。
【答案】实现了废弃物的综合利用或减少了酸雨的发生 MnO2+SO2 =MnSO4 取已加入一定量的H2O2的滤液Ⅰ少许置于试管中,加入少量的MnO2若有气体逸出即说明H2O2 足量。(若用K3[Fe(CN)6]检验Fe2+ 亦可给分) Fe(OH)3;Al(OH)3 在60℃下蒸发结晶 D 2HCO3-+Mn2+=MnCO3↓+H2O+CO2↑ 若温度过高NH4HCO3易分解,不利于碳酸锰的生成,温度低反应速率慢
【解析】
软锰矿(主要成分是MnO2,含有少量Fe2O3、Al2O3、MgO、SiO2)加入稀硫酸后, Fe2O3、Al2O3、MgO分别转变为Fe2(SO4)3 ,Al 2(SO4)3,Mg SO4,二氧化硅做为滤渣除去,MnO2与二氧化硫反应生成硫酸锰,加入过氧化氢是为了检验二氧化锰是否反应完,再加碳酸锰,除去Fe2(SO4)3 ,Al 2(SO4)3,Mg SO4和MnSO4晶体用蒸发结晶法分离。
(1)根据题意,通过如下简化流程既可脱除燃煤尾气中的SO2,又能制备硫酸锰晶体,实现了资源的综合利用,上述流程中第一步浸锰脱硫是为了实现了废弃物的综合利用,减少了酸雨的发生;
(2)浸锰过程中软锰矿中的MnO2与SO2反应,生成硫酸锰,化学方程式为MnO2+SO2 = MnSO4;
(3)检验H2O2是否过量,在二氧化锰做催化剂的条件下是否分解释放氧气,或者加入含Fe2+的K3[Fe(CN)6的溶液,H2O2过量会氧化Fe2+,蓝色沉淀会褪色,则判断方法为取已加入一定量的H2O2的滤液Ⅰ少许置于试管中,加入少量的MnO2若有气体逸出即说明H2O2足量(或取已加入一定量的H2O2的滤液Ⅰ少许置于试管中,加入含Fe2+的K3[Fe(CN)6] 溶液,若蓝色沉淀褪色,则说明H2O2 足量);加MnCO3调节溶液的pH,将Fe3+,Al3+生成难溶于水的氢氧化物,所得滤渣的主要成分有Fe(OH)3 ,Al(OH)3;
(4)从图像可以看出,在60℃下,硫酸锰晶体的溶解度变化不大,硫酸镁晶体的溶解度变化较大,温度越高,溶解度越大,所以在60℃下蒸发结晶,可以得到较多的硫酸锰晶体,趁热过滤;根据溶解度曲线可知,硫酸锰晶体与杂质硫酸镁相比,杂质跟易溶于水需用水洗涤,但为减少产品的损失,应控制水的比例,则洗涤硫酸锰时最好选择乙醇的水溶液最好;
(5)硫酸锰加入NH4HCO3制得碳酸锰,锰离子和碳酸根离子发生双水解反应2HCO3-+Mn2+ = MnCO3↓+H2O+CO2↑;50℃碳化,说明反应不超过50℃最佳,由于碳酸氢铵易分解,生成氨气,二氧化碳和水,一旦碳酸氢铵分解,不利于碳酸锰的生成,但是温度也不能太低,温度太低,反应速率太慢。


科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.50 mol CH4和1.20 mol NO2充入体积为1 L的密闭容器中,发生如下反应:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
N2(g)+CO2(g)+2H2O(g),测得n(CH4)随时间变化数据如下表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是
A. T2时,CH4的平衡转化率为30.0%
B. 该反应的△H>0、T1<T2
C. 保持其他条件不变,T1时向平衡体系中再充入0.30molCH4和0.80mol H2O(g),平衡向正反应方向移动
D. 保持其他条件不变,T1时向平衡体系中再充入0.50molCH4和1.20molNO2,与原平衡相比,达新平衡时N2的浓度增大、体积分数减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温下,pH=2的两种一元酸x和y,体积均为100mL,稀释过程中pH与溶液体积的关系如图所示。分别滴加NaOH溶液至滴定终点,消耗NaOH溶液的体积为Vx、Vy,则

A.x为弱酸,Vx<VyB.x为强酸,Vx>Vy
C.y为弱酸,Vx<VyD.y为强酸,Vx>Vy
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2 L密闭容器中,800℃时反应2NO(g)+O2(g)![]() 2NO2(g)体系中,n(NO)随时间的变化如表:
2NO2(g)体系中,n(NO)随时间的变化如表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
n(NO)/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
(1)上述反应________(填“是”或“不是”)可逆反应。
(2)如图所示,表示NO2变化曲线的是______。用O2表示从0~2s内该反应的平均速率v=________。
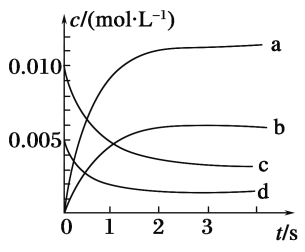
(3)能说明该反应已达到平衡状态的是________(填序号)。
a.v(NO2)=2v(O2)
b.容器内压强保持不变
c.v逆(NO)=2v正(O2)
d.容器内密度保持不变
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2018年8月3日我国确诊首例非洲猪瘟疫情。目前某有效药物的主要成分——姜黄素(分子式为C12H20O6)的一种合成路线如图所示:
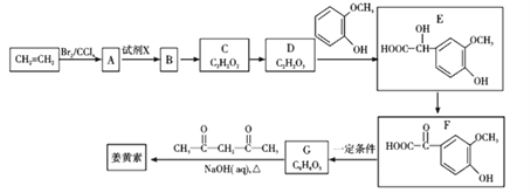
已知:
①![]()
![]() CH3CHO+CO2↑
CH3CHO+CO2↑
②CH3CHO+
![]()
![]() +H2O
+H2O
回答下列问题:
(1)A的名称为_________;试剂X为_________。
(2)D中含有的官能团名称为_________。
(3)反应D→E的化学方程式为______________________________,其反应类型是________。
(4)下列有关G(C8H8O3)的叙述不正确的是_________(填正确答案编号)。
a.能与NaHCO3溶液反应 b.能与浓溴水发生取代反应
c.能与FeCl3溶液发生显色反应 d.l mol G最多能与3 mol H2发生加成反应
(5)姜黄素的结构简式为_________。
(6)G(C8H8O3)的同分异构体中,写出同时符合下列条件的结构简式为_________。
①苯环上的一取代物只有2种;
②核磁共振氢谱中有4组吸收峰;
③l mol该物质与烧碱溶液反应,最多消耗3 mol NaOH。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Anammox法是一种新型的氨氮去除技术。设阿伏加德罗常数的数值为NA,则下列说法正确的是

A.1moLNH4+所含电子数为11NA
B.30g N2H2中含有的共用电子对数目为4 NA
C.过程II属于还原反应,过程IV属于氧化反应
D.过程I中反应得到的还原产物与氧化产物物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D是四种短周期元素,它们的原子序数依次增大,其中,A、C及B、D分别是同主族元素;A元素的原子半径是所有主族元素中原子半径最小的;B、D两元素的原子核中质子数之和是A、C两元素原子核中质子数之和的2倍;四种元素所形成的单质中A、B单质是气体,C、D单质是固体。
(1)写出以下元素的名称:B___;C___。
(2)写出D元素在周期表中的位置___。
(3)用电子式表示C2D的形成过程:___。
(4)写出由B、C两元素所形成的原子个数比为1:1的化合物的的电子式___;属于___(填“离子”或“共价”)化合物,存在的化学键的种类有___;写出它与水反应的化学方程式___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中 W 元素的原子序数为Z元素原子序数的两倍,下列说法正确的是
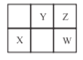
A.X在元素周期表中位于第3周期第VIA 族
B.X、Y、Z三种元素对应原子的半径依次减小
C.XZ2 和YZ2 的化学性质相似
D.利用 W 的含氧酸酸性强于Y 的含氧酸酸性,可证明非金属性:W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为有效控制雾霾,各地积极采取措施改善大气质量。其中,控制空气中氮氧化物和硫氧化物的含量尤为重要。
(1)煤燃烧产生的烟气中含有氮的氧化物,用CH4催化还原NO2可消除氮氧化物的污染。已知:
①CH4(g)+2NO2(g)=N2(g)+CO2(g)+2H2O(g) △H= -867.0kJ/mol;
②N2(g)+2O2(g)=2NO2(g) △H=+67.8kJ/mol;
③N2(g)+O2(g)=2NO(g) △H=+89.0kJ/mol
则CH4催化还原NO的热化学方程式为_______。
(2)将0.20mol NO和0.10mol CO充入一个温度恒定、容积恒为2L的密闭容器中发生反应2NO(g)+2CO(g)=N2(g)+2CO2(g),可实现氮氧化物的转化,反应过程中部分物质的物质的量变化如图所示。
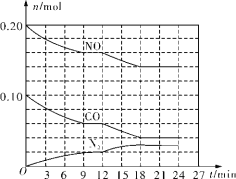
①N2在0~9min内的平均反应速率v(N2)=________mol/(L·min)(保留两位有效数字)。
②第12min时改变的反应条件可能为________(填字母代号)。
a.充入水蒸气稀释反应物 b.加入NO c.加催化剂 d.增大压强
(3)室温下,烟气中的SO2可用某浓度的NaOH溶液吸收得到pH=7的溶液,试计算所得溶液中![]() =_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
=_____(已知:常温下H2SO3的电离平衡常数Ka1=1.0×10-2,Ka2=6.0×10-8)。
(4)烟气中的SO2也可用Na2SO3溶液吸收,吸收过程中,pH随n(SO32-):n(HSO3-)变化关系如下表:
n(SO32-):n(HSO3-) | 99:1 | 1:1 | 1:99 |
pH | 8.2 | 7.2 | 6.2 |
当吸收液呈中性时,溶液中离子浓度关系正确的是(选填字母): ___________
a.c(Na+)=2c(SO32-)+c(HSO3-)
b.c(Na+)>c(HSO3-)>c(SO32-)>c(H+)=c(OH-)
c.c(Na+)+c(H+) =c(SO32-)+c(HSO3-)+c(OH-)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com