
ЁОЬтФПЁПдк2 LУмБеШнЦїжаЃЌ800ЁцЪБЗДгІ2NOЃЈgЃЉЃЋO2ЃЈgЃЉ![]() 2NO2ЃЈgЃЉЬхЯЕжаЃЌnЃЈNOЃЉЫцЪБМфЕФБфЛЏШчБэЃК
2NO2ЃЈgЃЉЬхЯЕжаЃЌnЃЈNOЃЉЫцЪБМфЕФБфЛЏШчБэЃК
ЪБМф/s | 0 | 1 | 2 | 3 | 4 | 5 |
nЃЈNOЃЉ/mol | 0.020 | 0.010 | 0.008 | 0.007 | 0.007 | 0.007 |
ЃЈ1ЃЉЩЯЪіЗДгІ________ЃЈЬюЁАЪЧЁБЛђЁАВЛЪЧЁБЃЉПЩФцЗДгІЁЃ
ЃЈ2ЃЉШчЭМЫљЪОЃЌБэЪОNO2БфЛЏЧњЯпЕФЪЧ______ЁЃгУO2БэЪОДг0ЁЋ2sФкИУЗДгІЕФЦНОљЫйТЪvЃН________ЁЃ
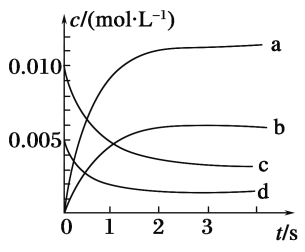
ЃЈ3ЃЉФмЫЕУїИУЗДгІвбДяЕНЦНКтзДЬЌЕФЪЧ________ЃЈЬюађКХЃЉЁЃ
aЃЎvЃЈNO2ЃЉЃН2vЃЈO2ЃЉ
bЃЎШнЦїФкбЙЧПБЃГжВЛБф
cЃЎvФцЃЈNOЃЉЃН2vе§ЃЈO2ЃЉ
dЃЎШнЦїФкУмЖШБЃГжВЛБф
ЁОД№АИЁПЃЈ1ЃЉЪЧЁЁЃЈ2ЃЉbЁЁ1.5ЁС10Ѓ3molЁЄЃЈLЁЄsЃЉЃ1ЁЁЃЈ3ЃЉbc
ЁОНтЮіЁПЃЈ1ЃЉИУЗДгІЪЧПЩФцЗДгІЁЃ
ЃЈ2ЃЉгЩЦНКтЬхЯЕ2NOЃЈgЃЉЃЋO2ЃЈgЃЉ![]() 2NO2ЃЈgЃЉжЊЃЌNO2ЮЊЩњГЩЮяЃЌnЃЈNO2ЃЉЃНІЄnЃЈNOЃЉЃН0.020molЃ0.007molЃН0.013mol
2NO2ЃЈgЃЉжЊЃЌNO2ЮЊЩњГЩЮяЃЌnЃЈNO2ЃЉЃНІЄnЃЈNOЃЉЃН0.020molЃ0.007molЃН0.013mol
cЃЈNO2ЃЉЃН![]() ЃН0.006 5molЁЄLЃ1
ЃН0.006 5molЁЄLЃ1
ЙЪБэЪОNO2БфЛЏЧњЯпЕФЮЊbЁЃ
vЃЈNOЃЉЃН![]() ЃН
ЃН![]() ЃН
ЃН![]() ЃН0.003molЁЄЃЈLЁЄsЃЉЃ1ЃЌ
ЃН0.003molЁЄЃЈLЁЄsЃЉЃ1ЃЌ
дђvЃЈO2ЃЉЃН![]() vЃЈNOЃЉЃН0.001 5molЁЄЃЈLЁЄsЃЉЃ1ЁЃ
vЃЈNOЃЉЃН0.001 5molЁЄЃЈLЁЄsЃЉЃ1ЁЃ
ЃЈ3ЃЉaЯюжаЮДжИУїе§ЁЂФцЗДгІЫйТЪЃЌЙЪЮоЗЈЫЕУїИУЗДгІЪЧЗёДяЕНЦНКтзДЬЌЃЛгЩгкИУЗДгІЪЧЗДгІЧАКѓЦјЬхЬхЛ§ВЛЯрЕШЕФЗДгІЃЌЕБШнЦїФкбЙЧПБЃГжВЛБфЪБЃЌЫЕУїИУЗДгІвбДяЕНЦНКтзДЬЌЃЌЙЪbЯюе§ШЗЃЛcЯюжавбЫЕУїе§ЁЂФцЗДгІЫйТЪЯрЕШЃЌЙЪЫЕУїИУЗДгІвбДяЕНЦНКтзДЬЌЃЛгЩгкЦјЬхзмжЪСПВЛБфЃЌЦјЬхзмЬхЛ§вВВЛБфЃЌвђДЫЃЌЮоТлИУЗДгІЪЧЗёДяЕНЦНКтЃЌШнЦїФкУмЖШБЃГжВЛБфЃЌЙЪdЯюЮоЗЈЫЕУїИУЗДгІЪЧЗёДяЕНЦНКтзДЬЌЁЃ



| ФъМЖ | ИпжаПЮГЬ | ФъМЖ | ГѕжаПЮГЬ |
| ИпвЛ | ИпвЛУтЗбПЮГЬЭЦМіЃЁ | ГѕвЛ | ГѕвЛУтЗбПЮГЬЭЦМіЃЁ |
| ИпЖў | ИпЖўУтЗбПЮГЬЭЦМіЃЁ | ГѕЖў | ГѕЖўУтЗбПЮГЬЭЦМіЃЁ |
| ИпШ§ | ИпШ§УтЗбПЮГЬЭЦМіЃЁ | ГѕШ§ | ГѕШ§УтЗбПЮГЬЭЦМіЃЁ |
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдк300 mLЕФУмБеШнЦїжаЃЌЗХШыФјЗлВЂГфШывЛЖЈСПЕФCOЦјЬхЃЌвЛЖЈЬѕМўЯТЗЂЩњЗДгІЃКNi(s)ЃЋ4CO(g) ![]() Ni(CO)4(g)ЃЌвбжЊИУЗДгІЦНКтГЃЪ§гыЮТЖШЕФЙиЯЕШчБэЫљЪОЃК
Ni(CO)4(g)ЃЌвбжЊИУЗДгІЦНКтГЃЪ§гыЮТЖШЕФЙиЯЕШчБэЫљЪОЃК
ЮТЖШ/Ёц | 25 | 80 | 230 |
ЦНКтГЃЪ§ | 5ЁС104 | 2 | 1.9ЁС10Ѓ5 |
ЯТСаЫЕЗЈе§ШЗЕФЪЧ(ЁЁЁЁ)
A. ЩЯЪіЩњГЩNi(CO)4(g)ЕФЗДгІЮЊЮќШШЗДгІ
B. 25 ЁцЪБЗДгІNi(CO)4(g) ![]() Ni(s)ЃЋ4CO(g)ЕФЦНКтГЃЪ§ЮЊ0.5
Ni(s)ЃЋ4CO(g)ЕФЦНКтГЃЪ§ЮЊ0.5
C. дк80 ЁцЪБЃЌВтЕУФГЪБПЬЃЌNi(CO)4ЁЂCOХЈЖШОљ0.5 mol/LЃЌдђДЫЪБvе§>vФц
D. 80 ЁцДяЕНЦНКтЪБЃЌВтЕУn(CO)ЃН0.3 molЃЌдђNi(CO)4ЕФЦНКтХЈЖШЮЊ2 mol/L
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкУмБеШнЦїжагаПЩФцЗДгІЃК![]() ЃЛ
ЃЛ![]() ДІгкЦНКтзДЬЌ
ДІгкЦНКтзДЬЌ![]() вбжЊ
вбжЊ![]() ЃЌдђЯТСаЫЕЗЈе§ШЗЕФЪЧ
ЃЌдђЯТСаЫЕЗЈе§ШЗЕФЪЧ![]()
ЂйЩ§ЮТЪБ![]() ЕФжЕМѕаЁЂкНЕбЙЪБЬхЯЕФкЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПМѕаЁЂлМгШыBЃЌAЕФзЊЛЏТЪБфДѓЂмМгШыДпЛЏМСЃЌЦјЬхЕФзмЮяжЪЕФСПВЛБфЂнГфШыCЃЌдђAЁЂBЕФЮяжЪЕФСПдіДѓ
ЕФжЕМѕаЁЂкНЕбЙЪБЬхЯЕФкЛьКЯЦјЬхЕФЦНОљЯрЖдЗжзгжЪСПМѕаЁЂлМгШыBЃЌAЕФзЊЛЏТЪБфДѓЂмМгШыДпЛЏМСЃЌЦјЬхЕФзмЮяжЪЕФСПВЛБфЂнГфШыCЃЌдђAЁЂBЕФЮяжЪЕФСПдіДѓ
A.ЂлЂмB.ЂйЂкЂнC.ЂкЂлЂнD.ШЋВП
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПдкКуЮТКуШнЕФУмБеШнЦїжаЭЈШывЛЖЈСПЕФAЁЂBЃЌЗЂЩњЗДгІA(gЃЉЃЋ2B(gЃЉ![]() 3C(gЃЉЁЃШчЭМЪЧAЕФЗДгІЫйТЪЃі(AЃЉЫцЪБМфБфЛЏЕФЪОвтЭМЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ
3C(gЃЉЁЃШчЭМЪЧAЕФЗДгІЫйТЪЃі(AЃЉЫцЪБМфБфЛЏЕФЪОвтЭМЁЃЯТСаЫЕЗЈе§ШЗЕФЪЧЃЈ ЃЉ

AЃЎЗДгІЮяAЕФХЈЖШЃКaЕуаЁгкbЕу
BЃЎИУЗДгІЕФФГжжЩњГЩЮяПЩФмЖдЗДгІЦ№ДпЛЏзїгУ
CЃЎЧњЯпЩЯЕФcЁЂdСНЕуЖМБэЪОДяЕНЦНКтзДЬЌ
DЃЎAЕФЦНОљЗДгІЫйТЪЃКabЖЮДѓгкbcЖЮ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГєбѕЪЧРэЯыЕФбЬЦјЭбЯѕМСЃЌЦфЭбЯѕЗДгІЮЊЃК![]() ВЛЭЌЮТЖШЯТЃЌдкШ§ИіШнЦїжаЗЂЩњЩЯЪіЗДгІЃЌЯрЙиаХЯЂШчЯТБэМАЭМЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
ВЛЭЌЮТЖШЯТЃЌдкШ§ИіШнЦїжаЗЂЩњЩЯЪіЗДгІЃЌЯрЙиаХЯЂШчЯТБэМАЭМЫљЪОЃЌЯТСаЫЕЗЈе§ШЗЕФЪЧ
ШнЦї | Мз | вв | Бћ |
ШнЛ§ | 1 | 1 | 2 |
ЗДгІЮяЦ№ЪМСП | 2mol | 2mol | 2mol |
ЮТЖШ |
|
|
|
A.![]() ФкМзШнЦїжаЗДгІЕФЦНОљЫйТЪЃК
ФкМзШнЦїжаЗДгІЕФЦНОљЫйТЪЃК![]()
B.![]() ЃЌ
ЃЌ
C.ЦНКтЪБ![]() ХЈЖШЃК
ХЈЖШЃК![]()
D.![]() ЪБЃЌШєЦ№ЪМЪБМфЯђШнЦїМзжаГфШы
ЪБЃЌШєЦ№ЪМЪБМфЯђШнЦїМзжаГфШы![]() ЁЂ
ЁЂ![]() ЁЂ
ЁЂ![]() КЭ
КЭ![]() ЃЌдђЭбЯѕЗДгІДяЕНЦНКтЧАЃЌ
ЃЌдђЭбЯѕЗДгІДяЕНЦНКтЧАЃЌ![]() е§
е§![]() Фц
Фц![]()
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁП25ЁцЪБЃЌЫФжжОљЮЊ0.1molLЉ1ЕФШмвКЃЌЦфpHШчЯТБэЫљЪОЃЌЯТСаЙиЯЕВЛе§ШЗЕФЪЧЃЈ ЃЉ
ађКХ | Ђй | Ђк | Ђл | Ђм |
ШмвК | NaCl | CH3COONH4 | NaHCO3 |
|
pH | 7.0 | 7.0 | 8.4 | 9.9 |
A.ЫсадЃКH2CO3ЃО![]()
B.ЫЎЕчРыВњЩњЕФcЃЈH+ЃЉЃКЂй=Ђк
C.ШмвКЂлжаЃКc(HCO3Ѓ)+c(CO32Ѓ)+c(H2CO3)= 0.1molLЉ1
D.ШмвКЂмжаЃКc(Na+)ЃОc(![]() )ЃОc(OHЃ)ЃОc(H+)
)ЃОc(OHЃ)ЃОc(H+)
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПСђЫсУЬЪЧживЊЕФЮЂСПдЊЫиЗЪСЯжЎвЛЃЌвзШмгкЫЎЃЌФбШмгкввДМЁЃЙЄвЕЩЯгУШэУЬПѓЃЈжївЊГЩЗжЪЧMnO2ЃЌКЌгаЩйСПFe2O3ЁЂAl2O3ЁЂMgOЁЂSiO2ЃЉЭЈЙ§ШчЯТМђЛЏСїГЬМШПЩЭбГ§ШМУКЮВЦјжаЕФSO2ЃЌгжФмжЦБИСђЫсУЬОЇЬхЃЌЪЕЯжСЫзЪдДЕФзлКЯРћгУЃК
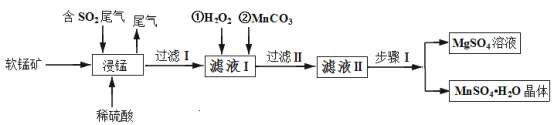
ЧыЛиД№ЯТСаЮЪЬтЃК
ЃЈ1ЃЉЩЯЪіСїГЬжаЕквЛВННўУЬЭбСђЕФКУДІЪЧ_________ЃЈД№ГівЛЕуМДПЩЃЉЁЃ
ЃЈ2ЃЉаДГіНўУЬЙ§ГЬжаШэУЬПѓжаЕФMnO2ЗЂЩњЕФЛЏбЇЗНГЬЪН_________ЁЃ
ЃЈ3ЃЉЭЈЙ§ЪЕбщШчКЮХаЖЈТЫвКЂёжавбМгШызуСПH2O2 __________ЃЛМгMnCO3ЕФФПЕФЪЧЕїНкШмвКЕФpHЃЌЪЙТЫвКЂёжаЕФЯрЙиРызгаЮГЩГСЕэЖјГ§ШЅЃЌЧыаДГі ЁАЙ§ТЫ ЂђЁБжаЫљЕУТЫдќЕФжївЊГЩЗжга________ЁЃ
ЃЈ4ЃЉвбжЊСђЫсУЬОЇЬхКЭСђЫсУООЇЬхЕФШмНтЖШЧњЯпШчЭМЫљЪОЁЃ
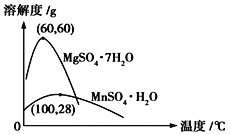
ЧыаДГіВНжшЂёВйзї_________ЁЂГУШШЙ§ТЫЃЛЮЊСЫБЃжЄВњЦЗЕФДПЖШЃЌЭЌЪБгжМѕЩйВњЦЗЕФЫ№ЪЇЃЌгІбЁдёЯТСаШмвКжаЕФ________ЃЈЬюбЁЯюзжФИЃЉНјааЯДЕгЃЌЪЕбщаЇЙћзюМбЁЃ
A ввДМ B БЅКЭK2SO4ШмвК C еєСѓЫЎ D ввДМЫЎШмвК
ЃЈ5ЃЉТЫвКЂђЛЙПЩЭЈЙ§МгШыЙ§СПNH4HCO3НјааЁА50ЁцЬМЛЏЁБЕУЕНИпДПЬМЫсУЬЃЌЗДгІЕФРызгЗНГЬЪНЮЊ_________ЁЃЁА50ЁцЬМЛЏЁБПЩФмЕФдвђЪЧЃК_________ЁЃ
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПКЌNaOH 20.0gЕФЯЁШмвКгызуСПЯЁбЮЫсЗДгІЃЌЗХГі28.7 kJЕФШШСПЃЌБэЪОИУЗДгІЕФШШЛЏбЇЗНГЬЪНе§ШЗЕФЪЧЃЈ ЃЉ
A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)ЁїH= +28.7 kJЁЄmol-1
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)ЁїH= _28.7 kJЁЄmol-1
C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)ЁїH=+57.4 kJЁЄmol-1
D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)ЁїH= _57.4 kJЁЄmol-1
ВщПДД№АИКЭНтЮі>>
ПЦФПЃКИпжаЛЏбЇ РДдДЃК ЬтаЭЃК
ЁОЬтФПЁПГЃЮТЯТЃЌЯТСаЫЕЗЈВЛе§ШЗЕФЪЧ
A.ЕШЬхЛ§ЁЂЕШЮяжЪЕФСПХЈЖШЕФNaCl(aq) РызгзмЪ§ДѓгкNaClO(aq)жаРызгзмЪ§
B.pH=3ЕФСђЫсШмвКжаЫЎЕФЕчРыГЬЖШЕШгкpH=11ЕФАБЫЎШмвКжаЫЎЕФЕчРыГЬЖШ
C.0.1 mol/LЕФNaHAШмвКpHЃН5ЃЌдђШмвКЃКc(HAЃ)ЃОc(HЃЋ)ЃОc(A2Ѓ)ЃОc(H2A)
D.ЯђNH4HSO4ШмвКжаЕЮМгNaOHШмвКжСжаадЃЌЫљЕУЛьКЯвКЃКc(NaЃЋ)ЃОc(NH4ЃЋ)ЃОc(SO42Ѓ)ЃОc(OHЃ)ЃНc(HЃЋ)
ВщПДД№АИКЭНтЮі>>
ЙњМЪбЇаЃгХбЁ - СЗЯАВсСаБэ - ЪдЬтСаБэ
КўББЪЁЛЅСЊЭјЮЅЗЈКЭВЛСМаХЯЂОйБЈЦНЬЈ | ЭјЩЯгаКІаХЯЂОйБЈзЈЧј | ЕчаХеЉЦОйБЈзЈЧј | ЩцРњЪЗащЮожївхгаКІаХЯЂОйБЈзЈЧј | ЩцЦѓЧжШЈОйБЈзЈЧј
ЮЅЗЈКЭВЛСМаХЯЂОйБЈЕчЛАЃК027-86699610 ОйБЈгЪЯфЃК58377363@163.com