
【题目】写出下列盐溶液水解的离子方程。
(1)(NH4)2SO4:______________________________________________;
(2)FeCl3:_________________________________________________;
(3)Na2CO3:_________________________________________________;
科目:高中化学 来源: 题型:
【题目】元素周期表的种类相当多,如大象式、回路式、能级式、亚历山大式等,教材上所附的长式周期表是目前使用最普遍的周期表。有一种非常有趣的钟表式周期表如图所示,下列说法正确的是( )

A.12:00时“时针”所指元素的金属性最强
B.从中午12:00点到晚上23:00点,“时针”所指元素的金属性依次减弱
C.9:55时“时针”和“分针”所指的两种元素(“针”所指以最近为准)形成的化合物中阴、阳离子之比为1:1
D.2:00时,“时针”和“分针”所指的元素的原子最外层均只有两个电子,性质相似
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、W为五种短周期元素。X、Y、Z是原子序数依次递增的同周期元素,且最外层电子数之和为15,X与Z可形成XZ2分子;Y与M形成的气态化合物的摩尔质量为17g/mol;W的质子数是X、Y、Z、M四种元素质子数之和的![]() 。下列说法正确的是
。下列说法正确的是
A.XZ2、M2Z2均为共价化合物
B.原子半径:W>Z>Y>X>M
C.由X元素形成的单质硬度一定很大
D.由X、Y、Z、M四种元素形成的化合物只含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值。下列说法正确的是( )
A.1 mol甲醇分子中含有的共价键数为4NA
B.2.4 g镁在足量的氧气中燃烧,转移的电子数为0.1NA
C.标准状况下,5.6 L二氧化碳气体中含有的氧原子数为0.5NA
D.1 L 0.5 mol/L CH3COONa溶液中含有的CH3COO-数为0.5NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】高铁酸钾(K2FeO4)具有高效的消毒作用,为一种新型非氯高效消毒剂。以废铁屑(含有少量Ni)为主要原料制备高铁酸钾的流程如下:
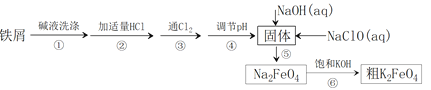
资料显示:一些金属氢氧化物开始沉淀和完全沉淀的pH如下:
M(OH)n | pH | |
开始沉淀 | 沉淀完全 | |
Fe(OH)3 | 2.53 | 2.94 |
Ni(OH)2 | 7.60 | 9.75 |
(1)高铁酸钾具有高效消毒主要是因其具有__________性所致。
(2)步骤③反应的离子方程式是_______。
(3)步骤④不能引入新杂质,调节pH所用的某种氧化物的化学式是___________,调节pH的范围是__________________。
(4)步骤⑤发生反应的离子方程式是________。
(5)该流程中可循环利用的物质是:_______(写化学式)。
(6)步骤⑥中,由Na2FeO4 得到粗K2FeO4的原理可能是___________。
(7)测定产品纯度:将wg粗产品,溶入过量的碱性亚铬酸盐溶液中,充分反应后,加入稀硫酸酸化至pH为2,在所得的重铬酸盐溶液中加入5滴二苯胺磺酸钠溶液作指示剂,然后用c mol·L1 (NH4)2Fe(SO4)2溶液滴定至终点,消耗滴定液V mL。有关滴定反应有:
Cr(OH)4-+FeO42-+3H2O![]() Fe(OH)3·3H2O↓+CrO42- +OH
Fe(OH)3·3H2O↓+CrO42- +OH
2![]() +2H
+2H![]()
![]() +H2O
+H2O
![]() +6Fe2++14H
+6Fe2++14H![]() 2Cr3++6Fe3++7H2O
2Cr3++6Fe3++7H2O
该粗产品中K2FeO4的纯度为____________(用含w、c、V的代数式表示)。若滴定管没有用待装液润洗,则测得结果________(“偏高”“偏低”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学反应伴随能量变化,获取反应能量变化有多条途径。
(1)下列反应中,属于吸热反应的是________(填字母)。
A.Na与水反应 B.甲烷的燃烧反应 C.CaCO3受热分解 D.锌与盐酸反应
(2)获取能量变化的途径
①通过化学键的键能计算。已知:
化学键种类 | H—H | O=O | O—H |
键能(kJ/mol) | a | b | c |
计算可得:2H2(g)+ O2(g) =2H2O(g) H=_________kJ·mol-1(用a、b、c表示)
②通过物质所含能量计算。已知反应中A+B= C+D中A、B、C、D所含能量依次可表示为EA、EB、EC、ED,该反应H=_________。
(3)已知:4g CH4完全燃烧生成CO2(g)、H2O(l)时放出热量222.5 kJ,则表示甲烷燃烧的热化学方程式为________。
(4)下图所示装置可以说明有化学能转化为电能的实验现象为__________。
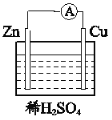
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知A、B、D是食品中的常见有机物,A是生物的主要供能物质。以A和水煤气(CO、H2)为原料在一定条件下可获得有机物B、C、D、E、F,其相互转化关系如图。已知E是CO和H2以物质的量之比1:2反应的产物,F为具有特殊香味、不易溶于水的油状液体。

请回答:
(1)有机物D中含有的官能团名称是______。
(2)B→C化学方程式是______。
(3)下列说法不正确的是______(填字母)。
A.有机物B与金属钠反应比水与金属钠反应要剧烈
B.除去F中含有D、E杂质可用NaOH溶液洗涤、分液
C.D和E反应生成F时,浓硫酸主要起强氧化剂作用
D.C在一定条件下可以与H2反应转化为B
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列条件下,对应离子一定能大量共存的是
A.在0.1mol/LNa2CO3溶液中:Al3+、![]() 、
、![]() 、
、![]()
B.pH=7的溶液中:Fe3+、Cl-、Na+、![]()
C.使甲基橙变红的溶液中:![]() 、Cl-、
、Cl-、![]() 、Mg2+
、Mg2+
D.25℃时,水电离出的 c(H+)=1×l0-13 mol/L的溶液中:K+、Ba2+、![]() 、S2-
、S2-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】草酸亚铁是合成锂离子电池正极材料磷酸亚铁锂的原料。某工厂以炼钢厂的脱硫渣(主要成分是Fe2O3)为原料生产电池级草酸亚铁晶体的工艺流程如下:
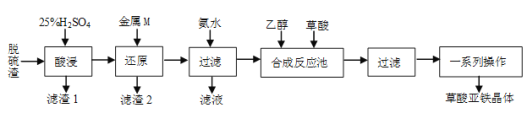
(1)要提高“酸浸”速率,宜采取的措施有___(填两条)。
(2)写出“还原”过程中既是化合反应又是氧化还原反应的离子方程式___。
(3)滤渣2中含有的TiOSO4在热水中易水解,生成H2TiO3,该反应的化学方程式为___。
(4)“滤液”经处理后得到一种化肥,其化学式为___。“一系列操作”指___。
(5)已知:298K时,Ksp[Fe(OH)2]=4.0×10-17,当离子浓度≤1.0×10-5molL-1时,视该离子已完全沉淀。上述流程中,加“氨水”调pH的范围为___(lg2≈0.3)。
(6)草酸亚铁晶体(FeC2O42H2O)纯度的测定:准确称取mg草酸亚铁晶体于锥形瓶中,加入一定量的稀硫酸溶液,并加热至50℃,用cmolL-1KMnO4标准溶液滴定,达到滴定终点时,用去标准溶液VmL。滴定反应(未配平):FeC2O42H2O+KMnO4+H2SO4→Fe2(SO4)3+CO2+MnSO4+K2SO4+H2O;则样品中FeC2O42H2O的纯度为___%(用含有m、c、V的代数式表示);若草酸亚铁晶体失去部分结晶水,测得的结果___(填“偏高”“偏低”或“无影响”)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com