
【题目】甲、乙两池电极材料都是铁棒与碳棒(如图),乙池箭头方向为电子移动方向。请回答:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的_________棒;乙池中的________棒。
②在乙池中阳极的电极反应是__________。
(2)若两池中均盛放滴加少量酚酞的饱和NaCl溶液。
①甲池中的铁容易发生腐蚀,该腐蚀属于电化学腐蚀中的_________腐蚀。
②测得乙池中有0.2mol电子发生转移,则标准状况下理论共有_________L气体生成。
【答案】C(碳) Fe(铁) 4OH--4e-=2H2O+O2↑ 吸氧 4.48L
【解析】
(1)若电解质溶液为硫酸铜溶液,甲池属于原电池,铁易失电子作负极,碳作正极,正极上铜离子得电子发生还原反应;乙池属于电解池,根据电子流向知,C电极为阳极,铁电极为阴极,阴极上铜离子得电子发生还原反应,阳极上氢氧根离子失电子;
(2)若电解质溶液为滴加少量酚酞的饱和NaCl溶液,
①甲装置是原电池,铁易失电子作负极,其电极反应式为Fe-2e-=Fe2+,电解质溶液为中性,据此分析解答;
②若电解质溶液为氯化钠溶液,则乙中为电解氯化钠溶液,阳极氯离子失电子生成氯气,阴极氢离子得电子生成氢气,根据电解池总反应计算解答。
(1)①若电解质溶液为硫酸铜溶液,甲装置是原电池,铁易失电子作负极,碳作正极,正极上铜离子得电子发生还原反应,生成红色的铜,乙池属于电解池,根据电子流向知,C电极为阳极,铁电极为阴极,阴极上铜离子得电子发生还原反应生成红色的铜;
②根据①分析可知,在乙池中铁电极为阴极,阴极上铜离子得电子发生还原反应生成红色的铜,其电极反应式为:Cu2++2e-=Cu;C电极为阳极,根据放电顺序,阳极上OH-放电,阳极的电极反应为:4OH--4e-=2H2O+O2↑;
(2)若电解质溶液为滴加少量酚酞的饱和NaCl溶液,
①甲装置是原电池,铁易失电子作负极,其电极反应式为Fe-2e-=Fe2+,电解质溶液为中性,C为正极,其电极反应为:2H2O+O2+4eˉ=4OH-,该腐蚀属于电化学腐蚀中的吸氧腐蚀;
②乙池属于电解池,根据电子流向知,C电极为阳极,Fe电极为阴极,乙中为电解氯化钠溶液,阳极氯离子失电子生成氯气,阴极氢离子得电子生成氢气,电解池总反应2Cl-+2H2O![]() 2OH-+H2↑+Cl2↑,根据反应可知,转移2mol电子生成1mol氢气和1mol氯气,则当有0.2mol电子发生转移时,生成0.1mol氢气和0.1mol氯气,标况下气体的体积为(0.1mol+0.1mol)×22.4L/mol=4.48L。
2OH-+H2↑+Cl2↑,根据反应可知,转移2mol电子生成1mol氢气和1mol氯气,则当有0.2mol电子发生转移时,生成0.1mol氢气和0.1mol氯气,标况下气体的体积为(0.1mol+0.1mol)×22.4L/mol=4.48L。


 小天才课时作业系列答案
小天才课时作业系列答案 一课四练系列答案
一课四练系列答案 黄冈小状元满分冲刺微测验系列答案
黄冈小状元满分冲刺微测验系列答案 新辅教导学系列答案
新辅教导学系列答案 阳光同学一线名师全优好卷系列答案
阳光同学一线名师全优好卷系列答案科目:高中化学 来源: 题型:
【题目】K2FeO4 在水中不稳定,发生反应:4FeO![]() +10H2O
+10H2O![]() 4Fe(OH)3(胶体)+8OH- +3O2
4Fe(OH)3(胶体)+8OH- +3O2![]() ,其稳定性与温度(T)和溶液 pH 的关系分别如图所示。下列说法正确的是
,其稳定性与温度(T)和溶液 pH 的关系分别如图所示。下列说法正确的是
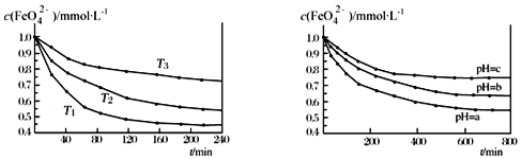
图 IK2FeO4 的稳定性与温度的关系 图 IIK2FeO4 的稳定性与溶液 pH 的关系
A.由图 I 可知 K2FeO4 的稳定性随温度的升高而升高B.由图 II 可知图中 a>c
C.由图 I 可知温度:T1>T2>T3D.由图 I 可知上述反应ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Anammox法是一种新型的氨氮去除技术。设阿伏加德罗常数的数值为NA,则下列说法正确的是

A.1moLNH4+所含电子数为11NA
B.30g N2H2中含有的共用电子对数目为4 NA
C.过程II属于还原反应,过程IV属于氧化反应
D.过程I中反应得到的还原产物与氧化产物物质的量之比为1:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】W、X、Y、Z四种短周期元素在元素周期表中的位置如图所示,其中 W 元素的原子序数为Z元素原子序数的两倍,下列说法正确的是
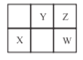
A.X在元素周期表中位于第3周期第VIA 族
B.X、Y、Z三种元素对应原子的半径依次减小
C.XZ2 和YZ2 的化学性质相似
D.利用 W 的含氧酸酸性强于Y 的含氧酸酸性,可证明非金属性:W>Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法正确的是
A. 简单离子半径R>W>Y>Z
B. 气态氢化物稳定性:HmW<HnR
C. Z2Y2电子式可表示为![]()
D. RY2和W2均有漂白性,将两者等物质的量混合溶于水,漂白性增强
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述与盐类水解无关的是( )
A.饱和食盐水使甲基橙显黄色
B.FeCl3溶液加热蒸干得到Fe2O3
C.NH4Cl溶液除铁锈
D.Na2CO3等盐溶液不能盛装在玻璃塞的试剂瓶中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列物质的溶液中粒子浓度关系不正确的是
A.![]() 的
的![]() 溶液:
溶液:![]()
B.![]() 和
和![]() 混合溶液:
混合溶液:![]()
C.三种相同浓度的铵盐溶液中![]() 从大到小的顺序:
从大到小的顺序:![]() 、
、![]() 、
、![]()
D.已知AgCl、AgBr、AgI溶度积常数依次为![]() 、
、![]() 、
、![]() ,则对应饱和溶液中
,则对应饱和溶液中![]() 从大到小的顺序为:
从大到小的顺序为:![]() 、
、![]() 、
、![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知甲基丙烯酸缩水甘油酯(GMA)主要用于高分子胶囊、离子交换树脂和印刷油墨的粘合剂。其合成路线如下:

请回答下列问题:
(1)GMA中的官能团名称是_________________________________。
(2)甘油的结构简式是___________,F的结构简式___________。
(3)请写出B→C、D→E的化学方程式,并判断反应类型:
B→C:_________________________________、___________反应;
D→E:_________________________________、___________反应。
(4)E的核磁共振氢谱峰面积之比由大到小为___________,E的同分异构体中能发生水解反应的链状化合物有___________种。
(5)已知CH2=CH2能在Ag作催化剂的条件下与O2反应生成![]() ,据此请设计一条由丙烯生成F的路线。____________________________________________。
,据此请设计一条由丙烯生成F的路线。____________________________________________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com