
【题目】下列叙述与盐类水解无关的是( )
A.饱和食盐水使甲基橙显黄色
B.FeCl3溶液加热蒸干得到Fe2O3
C.NH4Cl溶液除铁锈
D.Na2CO3等盐溶液不能盛装在玻璃塞的试剂瓶中
 开心蛙状元测试卷系列答案
开心蛙状元测试卷系列答案科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)![]() 3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )

A.反应物A的浓度:a点小于b点
B.该反应的某种生成物可能对反应起催化作用
C.曲线上的c、d两点都表示达到平衡状态
D.A的平均反应速率:ab段大于bc段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】含NaOH 20.0g的稀溶液与足量稀盐酸反应,放出28.7 kJ的热量,表示该反应的热化学方程式正确的是( )
A.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= +28.7 kJ·mol-1
B.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _28.7 kJ·mol-1
C.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H=+57.4 kJ·mol-1
D.NaOH(aq)+HCl(aq)==NaCl(aq)+H2O(l)△H= _57.4 kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两池电极材料都是铁棒与碳棒(如图),乙池箭头方向为电子移动方向。请回答:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的_________棒;乙池中的________棒。
②在乙池中阳极的电极反应是__________。
(2)若两池中均盛放滴加少量酚酞的饱和NaCl溶液。
①甲池中的铁容易发生腐蚀,该腐蚀属于电化学腐蚀中的_________腐蚀。
②测得乙池中有0.2mol电子发生转移,则标准状况下理论共有_________L气体生成。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,据溶液电导率变化可以确定滴定反应的终点。下图是某同学用0.1mol/L KOH 溶液分别滴定体积均为20mL、浓度均为0.1mol/L的HCl和CH3COOH 溶液滴定曲线示意图(混合溶液体积变化忽略不计)。下列有关判断不正确的是
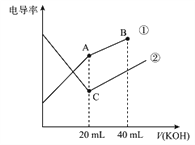
A. 曲线①代表0.1mol/L KOH 溶液滴定CH3COOH溶液的滴定曲线,曲线②代0.1mol/LKOH 溶液滴定HCl溶液的滴定曲线
B. 在相同温度下,C点水电离的c (H+) 大于A点水电离的c(H+)
C. 在A 点的溶液中有: c(CH3COO-)+c(OH-)-c (H+)=0.05mol/L
D. 在B 点的溶液中有: c(K+)>c(OH-)>c(CH3COO-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,下列说法不正确的是
A.等体积、等物质的量浓度的NaCl(aq) 离子总数大于NaClO(aq)中离子总数
B.pH=3的硫酸溶液中水的电离程度等于pH=11的氨水溶液中水的电离程度
C.0.1 mol/L的NaHA溶液pH=5,则溶液:c(HA-)>c(H+)>c(A2-)>c(H2A)
D.向NH4HSO4溶液中滴加NaOH溶液至中性,所得混合液:c(Na+)>c(NH4+)>c(SO42-)>c(OH-)=c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下图是部分短周期主族元素原子半径与原子序数的关系图。下列说法正确的是( )
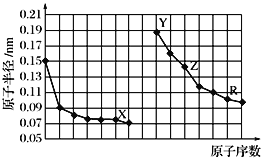
A. Z和R所形成的化合物,不能通过溶液中复分解反应而制得
B. 简单离子的半径关系是:R>Y>Z>X
C. X和Y所形成的一种化合物,可用于自来水消毒
D. 工业上获得单质Z的方法,一般是通过电解其熔融氯化物来实现
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。

已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中,LiCoO2发生反应的离子方程式为:___,该过程温度通常控制在40℃以下的原因是:___。
(2)“除铝铁”过程的两种试剂的作用分别是___,___。
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式:___。并计算室温下该反应的平衡常数K=___,已知:25℃时Kap(CuS)=8.5×10-45,已知H2S在水中的的电离常数:K1=1.3×10-7,K2=7.l×10-15
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因___。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是___。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1mol·L-1,部分锂盐的溶解度数据如下表所示。

结合数据分析,沉锂过程所用的试剂b是___(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,___,___,洗涤干燥。检验沉淀洗净的方法是___。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com