
【题目】某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。

已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中,LiCoO2发生反应的离子方程式为:___,该过程温度通常控制在40℃以下的原因是:___。
(2)“除铝铁”过程的两种试剂的作用分别是___,___。
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式:___。并计算室温下该反应的平衡常数K=___,已知:25℃时Kap(CuS)=8.5×10-45,已知H2S在水中的的电离常数:K1=1.3×10-7,K2=7.l×10-15
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因___。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是___。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1mol·L-1,部分锂盐的溶解度数据如下表所示。

结合数据分析,沉锂过程所用的试剂b是___(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,___,___,洗涤干燥。检验沉淀洗净的方法是___。
【答案】2LiCoO2+H2O2+6H+=2Li++2Co2++O2↑+4H2O 防止H2O2受热分解 将Fe2+氧化为Fe3+ 调节pH,促进水解除去Fe3+和Al3+ Cu2++H2S![]() CuS↓+2H+ 1.1×1023 过量的C2O42-与Co2+反应生成Co(C2O4)n2(n-1)-而溶解 它的溶解度随温度升高而逐渐增大 Na2CO3 加热浓缩 趁热过滤 取最后一次洗涤液,加稀盐酸酸化,再加溶液,如无沉淀则已洗净
CuS↓+2H+ 1.1×1023 过量的C2O42-与Co2+反应生成Co(C2O4)n2(n-1)-而溶解 它的溶解度随温度升高而逐渐增大 Na2CO3 加热浓缩 趁热过滤 取最后一次洗涤液,加稀盐酸酸化,再加溶液,如无沉淀则已洗净
【解析】
(1) LiCoO2为电极材料,故不能拆写,结合流程分析需要将三价钴还原为二价,故H2O2被氧化生成氧气;
(2) 氯酸钠将Fe2+氧化为Fe3+,碳酸钠调节pH,促进水解除去Fe3+和Al3+;
(3)Cu2++H2S![]() CuS+2H+,K=
CuS+2H+,K=  ,分子分母同时乘以c(HS-)、c(S2-),再进行化简计算即可;
,分子分母同时乘以c(HS-)、c(S2-),再进行化简计算即可;
(4) ①随n(C2O42-):N(Co2+)比值的增加,过量的C2O42-与Co2+反应生成Co(C2O4)n2(n-1)-而溶解,钴的沉淀率先逐渐增大后又逐渐减小;
②沉淀反应时间为10 min,温度在50℃以上时,溶解度随温度升高而逐渐增大;
(5)由于Li2CO3的溶解度更小,故应加入碳酸盐将Li+转化为Li2CO3,因为滤液a中Li+浓度较小,故最佳方法应在高于室温时进行结晶以提高产率;沉淀洗涤时应针对SO42-检验而不能采用焰色反应的方法去检验。
(1) LiCoO2为电极材料,故不能拆写,结合流程分析需要将三价钴还原为二价,故H2O2被氧化生成氧气,反应的离子方程式为:2LiCoO2+H2O2+6H+=2Li++2Co2++O2↑+4H2O;该过程温度通常控制在40℃以下的原因是:防止H2O2受热分解;
(2) “除铝铁”过程的两种试剂的作用分别是:氯酸钠将Fe2+氧化为Fe3+,碳酸钠调节pH,促进水解除去Fe3+和Al3+;
(3)Cu2++H2![]() CuS+2H+,K=
CuS+2H+,K= =
= ![]() =
=![]() =1.1×1023;
=1.1×1023;
(4) ①随n(C2O42-):N(Co2+)比值的增加,过量的C2O42-与Co2+反应生成Co(C2O4)n2(n-1)-而溶解,钴的沉淀率先逐渐增大后又逐渐减小;
②沉淀反应时间为10 min,温度在50℃以上时,溶解度随温度升高而逐渐增大;
(5)由于Li2CO3的溶解度更小,故应加入Na2CO3将Li+转化为Li2CO3,因为滤液a中Li+浓度较小,故最佳方法应在高于室温时进行结晶以提高产率;沉淀洗涤时应针对SO42-检验而不能采用焰色反应的方法去检验。相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,加热浓缩,趁热过滤,洗涤干燥。检验沉淀洗净的方法是取最后一次洗涤液,加稀盐酸酸化,再加溶液,如无沉淀则已洗净。


科目:高中化学 来源: 题型:
【题目】某溶液,只含以下离子中的若干种:K+、NH4+、Ba2+、Cl﹣、NO3﹣、SO42﹣,现取三份100mL溶液分别进行如下实验:
①第一份加入稀硝酸无明显现象,再加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液后加热,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得沉淀4.66g,加盐酸,沉淀质量不变。
根据以上实验,回答下列问题:
(1)溶液中不能确定是否存在的离子是_____,一定存在的阴离子是_____
(2)实验③间接表明溶液中不存在的离子是_____,实验②发生反应的离子方程式为_____
(3)小明根据上述实验认为该溶液中一定存在的阳离子为NH4+和_____,判断的依据是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
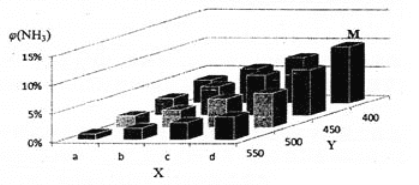
【题目】1913年,德国化学家哈伯实现了合成氨的工业化生产,被称作解救世界粮食危机的化学天才。现将lmolN2和3molH2投入1L的密闭容器,在一定条件下,利用如下反应模拟哈伯合成氨的工业化生产: N2(g) +3H2(g) ![]() 2NH3(g)△H < 0 当改变某一外界条件(温度或压强)时,NH3的体积分数φ(NH3)变化趋势如下图所示。
2NH3(g)△H < 0 当改变某一外界条件(温度或压强)时,NH3的体积分数φ(NH3)变化趋势如下图所示。
(1)已知:①NH3(l) ![]() NH3(g) ΔH1 ②N2(g)+3H2(g)
NH3(g) ΔH1 ②N2(g)+3H2(g) ![]() 2NH3(l) ΔH2,则反应N2(g)+3H2(g)
2NH3(l) ΔH2,则反应N2(g)+3H2(g) ![]() 2NH3(g)的△H=________(用含△H1、△H2的代数式表示)。
2NH3(g)的△H=________(用含△H1、△H2的代数式表示)。
(2)X轴上a点的数值比b点 _____(填“大”或“小”),Y轴表示_______(填“温度”或“压强”)。
(3)将1mol N2和3mol H2分别投入起始容积为1L的密闭容器中,实验条件相关数据如下表所示:
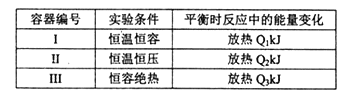
下列判断正确的是________。
A.放出热量:Ql< Q2<|△H| B.N2的转化率:I> III
C.平衡常数:II >I D.达平衡时氨气的体积分数:I>II
(4)平衡时,M点NH3的体积分数为10%。若同温同容下,再充入0.2mol N2,0.6mol H2和1.6molNH 3,重新达平衡时NH3的体积分数________ 10%(填“>”、“<”、“=”或“无法确定”)。
(5)某科研小组探究在其他条件不变的情况下,改变起始物氢气的物质的量对合成NH3反应的影响.实验结果如图所示:(图中T2和T1表示温度,n表示起始时H2的物质的量)
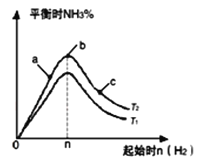
①图象中T2和T1的关系是:T2_____T1(填“>”、“<”、“=”或“无法确定”)。
②比较在a、b、c三点所处的平衡状态中,反应物N2的转化率最大的是___(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在一个密闭的玻璃管两端各放一团棉花,再用注射器同时在两端注入适量的浓氨水和浓盐酸,下列说法不正确的是
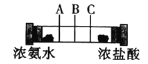
A.玻璃管中发生的反应可表示为:NH3+HCl=NH4Cl
B.实验时会在玻璃管的A处附近看到白雾
C.用手触摸玻璃管外壁,会感觉到有热量放出
D.将浓盐酸换成浓硝酸也会有相似现象
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化硫、氮气、二氧化碳组成的混合气体在同温、同压下与笑气(N2O)的密度相同,则该混合气体中二氧化硫、氮气、二氧化碳的质量比为( )
A.4:5:6B.22:1:14
C.64:35:13D.29:8:13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图为几种有机化合物的结构简式:
①CH3CH=CHCH2CH3②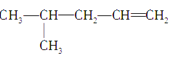 ③CH3CH2CH2CH2OH④CH3—C≡C—CH3⑤ CH3—CH2—C≡CH⑥
③CH3CH2CH2CH2OH④CH3—C≡C—CH3⑤ CH3—CH2—C≡CH⑥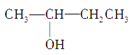 ⑦CH3CH2CH2OCH3⑧
⑦CH3CH2CH2OCH3⑧![]() ⑨CH2=CH—CH=CH2⑩ CH2=CHCH2CH2CH3
⑨CH2=CH—CH=CH2⑩ CH2=CHCH2CH2CH3
(1)属于同分异构体的是______、______、__________、__________。
(2)属于官能团位置不同的同分异构体是:________、__________、________。
(3)属于官能团类型不同的同分异构体是:____、____、____、____、____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A. NaCl(aq)![]() Cl2(g)
Cl2(g)![]() FeCl2(s)
FeCl2(s)
B. MgCl2(aq)![]() Mg(OH)2(s)
Mg(OH)2(s)![]() MgO (s)
MgO (s)
C. S(s)![]() SO3(g)
SO3(g)![]() H2SO4(aq)
H2SO4(aq)
D. N2(g)![]() NH3(g)
NH3(g)![]() Na2CO3(s)
Na2CO3(s)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.在镀件上电镀铜时,镀件应连接电源的负极
B.粗铜电解精炼时,若电路中通过2 mol e-,阳极减少64g
C.用惰性电极电解MgCl2溶液所发生反应的离子方程式为2Cl-+2H2O![]() Cl2↑+H2↑+2OH-
Cl2↑+H2↑+2OH-
D.用惰性电极电解饱和食盐水,阴极逸出的气体可使湿润的淀粉碘化钾试纸变蓝
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】芳香烃A是基本有机化工原料,由A制备高分子E和医药中间体K的合成路线(部分反应条件略去)如下图所示:
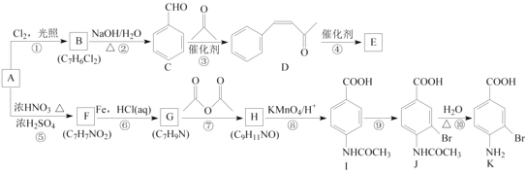
己知:①![]() ;
;
②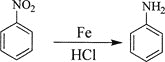
回答下列问题:
(1)A的名称是________,I含有官能团的名称是________。
(2)反应⑦的作用是________,⑩的反应类型是________。
(3)写出反应②的化学方程式:____________________________________________________。
(4)D分子中最多有________个原子共平面。E的结构简式为________。
(5)写出一种同时符合下列条件的F的同分异构体的结构简式:________。
①苯环上只有两种不同化学环境的氢原子;
②既能与银氨溶液反应又能与NaOH溶液反应。
(6)将由D为起始原料制备![]() 的合成路线补充完整。
的合成路线补充完整。
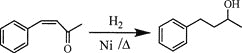 ________(无机试剂及溶剂任选)。
________(无机试剂及溶剂任选)。
合成路线流程图示例如下:
CH3CHO![]() CH3COOH
CH3COOH![]() CH3COOCH2CH3
CH3COOCH2CH3
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com