
【题目】二氧化硫、氮气、二氧化碳组成的混合气体在同温、同压下与笑气(N2O)的密度相同,则该混合气体中二氧化硫、氮气、二氧化碳的质量比为( )
A.4:5:6B.22:1:14
C.64:35:13D.29:8:13
【答案】C
【解析】
二氧化硫、氮气、二氧化碳组成的混合气体在同温、同压下与氮气的密度相同,说明混合气体的平均相对分子质量等于氮气的相对分子质量,为44,而二氧化碳的相对分子质量也为44,则二氧化硫、氮气的平均相对分子质量为44,以此解答该题。
二氧化硫、氮气、二氧化硫组成的混合气体在同温、同压下与N2O的密度相同,则混合气体的相对分子质量为44,由于CO2与N2O具有相同的相对分子质量,所以CO2、N2、SO2混合气体的平均相对分子质量仅由SO2和N2来决定,CO2的量可以任意;
设二氧化硫与氮气体积比为x:y,则:![]() =44,整理可得x:y=4:5,相同条件下气体体积之比等于物质的量之比,则二氧化硫和氮气的质量之比=(64×4):(28×5)=64:35,满足条件的选项为C,故答案为C。
=44,整理可得x:y=4:5,相同条件下气体体积之比等于物质的量之比,则二氧化硫和氮气的质量之比=(64×4):(28×5)=64:35,满足条件的选项为C,故答案为C。


科目:高中化学 来源: 题型:
【题目】由硫铁矿(主要成分:FeS2和SiO2)为主要原料得到绿矾(FeSO4·7H2O)的流程如下:
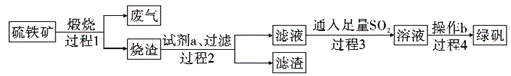
下列说法不正确的是( )
A. 过程1,废气中含SO2
B. 过程2,试剂a为稀硫酸
C. 过程3,离子方程式为2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. 过程4,将溶液加热到有较多固体析出,再用余热将液体蒸干,可得纯净绿矾
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,在27.5g水中溶解12.5g CuSO4·5H2O,恰好达到饱和,该溶液密度为1.21g /cm3,求:
① 该溶液中阴阳离子的总物质的量
② 该溶液中CuSO4的物质的量浓度
③ 取出20.0 ml该溶液,配成浓度为1.00 mol/L的稀溶液,则稀释后溶液的体积是多少毫升?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知N2H4在水中电离方式与NH3相似,若将NH3视为一元弱碱,则N2H4是一种二元弱碱,下列关于N2H4的说法不正确的是
A.它与硫酸形成的酸式盐可以表示为N2H5HSO4
B.它溶于水所得的溶液中共有4种离子
C.它溶于水发生电离的第一步可表示为:N2H4+H2O![]() N2H5+OH-
N2H5+OH-
D.室温下,向0.1mol/L的N2H4溶液加水稀释时,n(H+)·n(OH-)会增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某科研团队研究将磷钨酸(H3PW12O40,以下简称HPW)代替浓硫酸作为酯化反应的催化剂,但HPW自身存在比表面积小、易溶于有机溶剂而难以重复使用等缺点,将其负载在多孔载体(如硅藻土、C等)上则能有效克服以上不足,提高其催化活性。用HPW负载在硅藻土上催化制取乙酸正丁酯的酯化率与HPW负载量的关系(温度:120℃,时间:2h)如图所示,下列说法不正确的是

A.与HPW相比,HPW/硅藻土比表面积显著增加,有助于提高其催化性能
B.当HPW负载量为40%时达到饱和,酯化率最高
C.用HPW/硅藻土代替传统催化剂,可减少设备腐蚀等不足
D.不同催化剂对酯化率的影响程度主要取决于化学反应正向进行的程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某废旧电池材料的主要成分为钴酸锂(LiCoO2),还含有一定量的铁、铝、铜等元素的化合物,其回收工艺如图所示,最终可得到Co2O3和锂盐。

已知:CoC2O4·2H2O微溶于水,它的溶解度随温度升高而逐渐增大,且能与过量的C2O42-离子生成Co(C2O4)n2(n-1)-而溶解。
(1)“还原酸浸”过程中,LiCoO2发生反应的离子方程式为:___,该过程温度通常控制在40℃以下的原因是:___。
(2)“除铝铁”过程的两种试剂的作用分别是___,___。
(3)“除铜”所用试剂X为H2S,试写出该反应的离子方程式:___。并计算室温下该反应的平衡常数K=___,已知:25℃时Kap(CuS)=8.5×10-45,已知H2S在水中的的电离常数:K1=1.3×10-7,K2=7.l×10-15
(4)“沉钴”过程中,(NH4)2C2O4的加入量(图a)、沉淀反应的温度(图b)与钴的沉淀率关系如图所示:

①随n(C2O42-):N(Co2+)比值的增加,钴的沉淀率先逐渐增大后又逐渐减小的原因___。
②沉淀反应时间为10 min,温度在50℃以上时,随温度升高而钴的沉淀率下降的可能原因是___。
(5)已知“沉锂”过程中,滤液a中的c(Li+)约为10-1mol·L-1,部分锂盐的溶解度数据如下表所示。

结合数据分析,沉锂过程所用的试剂b是___(写化学式),相应的操作方法:向滤液a中加入略过量的试剂b,搅拌,___,___,洗涤干燥。检验沉淀洗净的方法是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.标准状况下,22.4 L 乙醇中含有碳原子数为2NA
B.6.0 g的SiO2固体含有0.1NA个SiO2分子
C.1L 0.5mol·L-1醋酸中含CH3COO-为0.5NA
D.12.0 g NaHSO4晶体中阴阳离子数为0.2 N
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将铁粉和活性炭的混合物用NaCl溶液湿润后,置于如图所示装置中,进行铁的电化学腐蚀实验。下列有关该实验的说法正确的是( )

A.铁被氧化的电极反应式为Fe3e=Fe3+
B.铁腐蚀过程中化学能全部转化为电能
C.一段时间后, 右侧导管液面会下降
D.活性炭的存在会加速铁的腐蚀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某工厂对工业生产钛白粉产生的废液进行综合利用,废液中含有大量FeSO4、H2SO4和少量Fe2(SO4)3、TiOSO4,可用于生产颜料铁红和补血剂乳酸亚铁.其生产工艺流程如下:
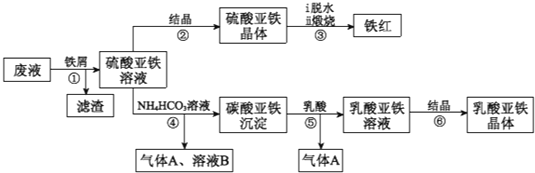
已知:①TiOSO4可溶于水,在水中可以电离为TiO2+和SO42-;
②TiOSO4水解的反应为:TiOSO4+(x+1)H2O→TiO2xH2O↓+H2SO4.
请回答:
(1)步骤①所得滤渣的主要成分为_____________,
(2)步骤③硫酸亚铁在空气中煅烧生成铁红和三氧化硫,该反应中氧化剂和还原剂的物质的量之比为_____________,
(3)步骤④需控制反应温度低于35℃,其目的是_____________,
(4)步骤④的离子方程式是_____________,
(5)已知:FeCO3(S)![]() Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
Fe2+(aq)+CO32-(aq),试用平衡移动原理解释步骤⑤生成乳酸亚铁的原因_____________,
(6)溶液B常被用于电解生产(NH4)2S2O8(过二硫酸铵)。电解时均用惰性电极,阳极发生的电极反应可表示为_____________,
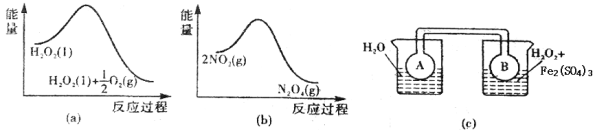
(7)Fe3+对H2O2的分解具有催化作用.利用图2(a)和(b)中的信息,按图2(c)装置(连通的A、B瓶中已充有NO2气体)进行实验.可观察到B瓶中气体颜色比A瓶中的深,其原因是_____________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com