
����Ŀ��ij��Һ��ֻ�����������е������֣�K+��NH4+��Ba2+��Cl����NO3����SO42������ȡ����100mL��Һ�ֱ��������ʵ�飺
�ٵ�һ�ݼ���ϡ���������������ټ���AgNO3��Һ�г�������
�ڵڶ��ݼ�����NaOH��Һ����ȣ��ռ�������0.04mol
�۵����ݼ�����BaCl2��Һ�ó���4.66g�������ᣬ�����������䡣
��������ʵ�飬�ش��������⣺
(1)��Һ�в���ȷ���Ƿ���ڵ�������_____��һ�����ڵ���������_____
(2)ʵ��ۼ�ӱ�����Һ�в����ڵ�������_____��ʵ��ڷ�����Ӧ�����ӷ���ʽΪ_____
(3)С����������ʵ����Ϊ����Һ��һ�����ڵ�������ΪNH4+��_____���жϵ�������_____��
���𰸡�NO3�� Cl����SO42�� Ba2+ NH4++OH��![]() NH3��+H2O K+ n(Cl��)+2n(SO42��)��n(NH4+)
NH3��+H2O K+ n(Cl��)+2n(SO42��)��n(NH4+)
��������
�ٵ�һ�ݼ���ϡ���������������ټ���AgNO3��Һ�г���������˵����Һ�к���Cl����
�ڵڶ��ݼ�����NaOH��Һ����ȣ��ռ�������0.04mol��˵������NH4����
�۵����ݼ�����BaCl2��Һ�ó���4.66g�������ᣬ�����������䣬˵������SO42������Ba2������n��SO42����=![]() =0.02mol����ϵ���غ�����⡣
=0.02mol����ϵ���غ�����⡣
(1)�����Ϸ�����֪һ������Cl�����Һ���0.02molSO42����0.04molNH4+���ɵ���غ��֪����K+������ȷ���Ƿ���NO3�����ʴ�Ϊ��NO3����Cl����SO42����
(2)ʵ��ۼ�ӱ�����Һ�в����ڵ�������Ba2+��ʵ��ڷ�����Ӧ�����ӷ���ʽΪNH4++OH��![]() NH3��+H2O���ʴ�Ϊ��Ba2+��NH4++OH��
NH3��+H2O���ʴ�Ϊ��Ba2+��NH4++OH��![]() NH3��+H2O��
NH3��+H2O��
(3)��n(Cl��)+2n(SO42��)��n(NH4+)��һ�����ڵ�������ΪNH4+��K+���ʴ�Ϊ��K+��n(Cl��)+2n(SO42��)��n(NH4+)��


 ��У����ϵ�д�
��У����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����NA��ʾ�����ӵ�������ֵ��������������ȷ����
A.1.8g 15NH3���еĵ�����ΪNA
B.1L 0.1 mol��L-1��������Һ�к��е���ԭ����Ϊ0.4NA
C.���³�ѹ�£�8g������к��еĵ�ԭ����Ϊ0.2NA
D.ͨ��״���£�22.4LCO2��CO�Ļ�����壬�����ʵ���С��1mol
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������Ϥ�ĵ��ͷǽ���Ԫ�أ��о������仯��������ʶ���������������о�����Ҫ���壬��ش��������⣺
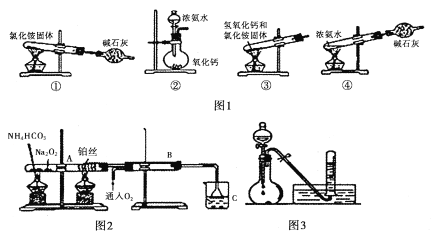
I. (1)ͼ1Ϊ��ȡ������װ�ú�ѡ�õ��Լ������к�������______________������ĸ����
A,�٢� B. �ڢ� C. �ڢ� D. �٢�
(2)ʵ�����Ʊ������Ļ�ѧ����ʽ��____________________________________��
II. ͼ2λ��ε����ȷֽ�װ��
(1)�����ȵIJ�˿��������Ӧ�Ļ�ѧ����ʽΪ____________________________________��
(2)B�г��ֵ�����Ϊ_______________________________________________________��
(3)��ͼ3���������ձ�C�з�Ӧ�õ����������Ũ��Һ��Cu��Ӧ��ʵ����Ϻ��Թ����ռ����������Ҫ�ɷ�Ϊ____________________��д��ѧʽ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����������ʣ�
��ʯī���������۾ƾ����ܰ�ˮ���ݶ�����̼����̼�����ƹ��壻���Ȼ�����Һ���ി����������ƹ��壻���Ȼ������塣
��1�������ܵ������___�����ڷǵ���ʵ���___������ǿ����ʵ���___������������ʵ���___��
��2��д�����ʢ�����ˮ�ĵ��뷽��ʽ��____��
��3��д�����ʢ͢���ˮ�з�Ӧ�����ӷ���ʽ��___��
��4��������Һ��ʱͨ������������___��Ȼ���ټ�ˮϡ�ͣ�ͨ��������Һ��__��Ũ���Է�ֹ�䷢��ˮ�⡣
��5��Ũ�ȡ������ͬ�Ģ�͢����Һ��������ͬ��״��������Zn������Ӧ���ʿ����___���ѧʽ����pHֵ�������ͬ�Ģ�͢����Һʱ������������������___�����ѧʽ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������(��Ҫ�ɷ֣�FeS2��SiO2)Ϊ��Ҫԭ�ϵõ��̷�(FeSO4��7H2O)���������£�
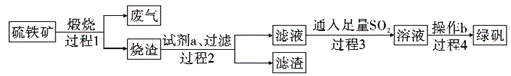
����˵������ȷ���ǣ� ��
A. ����1,�����к�SO2
B. ����2,�Լ�aΪϡ����
C. ����3,���ӷ���ʽΪ2Fe3++SO2+2H2O=2Fe2++SO42-+4H+
D. ����4,����Һ���ȵ��н϶��������,�������Ƚ�Һ�����ɣ��ɵô����̷�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ij�������Ժ�ˮ��Դ�ۺ����õ�ʾ��ͼ������������Ϣ���ж�������ط�������ȷ����
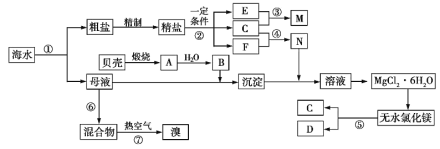
A. ������ȡMg�������У�û���漰�ķ�Ӧ�������û���Ӧ
B. �����Ļ�ѧ��������ȶ�����ȴ�����ˮ�Ȼ�þ���õ�þ����ʱ����ѡ����
C. ��Ӧ�����õ���̬�������ɴӱ��������ռѭ�����û�ӱ�������þ���ʴ�ѭ������
D. ��ĸҺ����ȡMg��Br2���Ⱥ�˳������ȡBr2������ȡMg
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���軯����һ�־綾���ʣ���ҵ�ϳ��������������Һ������ˮ�е��軯�ơ���������ƵĹ�ҵ�Ʊ�ԭ��Ϊ��2Na2S+Na2CO3+4SO2===3Na2S2O3+CO2 ��ij��ѧ��ȤС�����ø�ԭ����ʵ�����Ʊ���������ƣ�������軯�Ʒ�ˮ�����ŷ������
I.ʵ����ͨ����ͼ��ʾװ���Ʊ�Na2S2O3
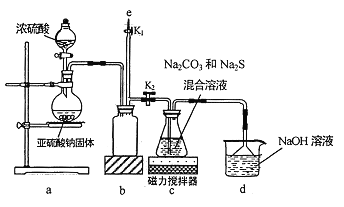
��1��ʵ����Ҫ����SO2�������ʣ��ɲ�ȡ�Ĵ�ʩ��_____________(д��һ��)��
��2��bװ�õ�������_____________ ��
��3����Ӧ��ʼ��c �����е���ɫ���Dz��������ֱ�Ϊ���壬�˻�����Ϊ__________(�ѧʽ)��
��4��ʵ���������e���������ʢ__________(����NaOH ��Һ������ˮ������CCl4���е�һ��) ��ע�������������IJ���Ϊ______________�������װ�á�
II.�軯�Ʒ�ˮ����
��5����֪: a.��ˮ���軯�Ƶ�����ŷű�Ϊ0.50mg/L��
b.Ag++2CN-==[Ag(CN)2]-��Ag++I-=AgI����AgI �ʻ�ɫ����CN-������Ag+��Ӧ��
ʵ������: ȡ20.00mL��������軯�Ʒ�ˮ����ƿ�У����μӼ���KI��Һ��ָʾ������1.00��10-4mol/L�ı�AgNO3��Һ�ζ�������AgNO3��Һ�����Ϊ1.50mL��
���ζ�ʱ1.00��10-4mol/L�ı�AgNO3��ҺӦ��________(����������) ʢװ�� �ζ��յ�ʱ��������______________��
��������ķ�ˮ�Ƿ�ﵽ�ŷű�_______(����������������)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼװ���У��������ڳ���0.1 mol NO���塣�������װ��һ����Na2O2����A������ͨ��CO2���塣�����£��������л���������D�������ƶ���������C��ʱ�������������С��Ϊԭ���9/10������������ʵ�����������2.24 g������CO2�ļ���ͨ�룬�������������ƶ�������˵������ȷ����

A. ������D���ƶ���C���Ĺ����У�ͨ���CO2����Ϊ2.24 L(��״��)
B. NO2ת��ΪN2O4��ת����Ϊ20%
C. ��������NO�ѷ�Ӧ��
D. ��������C������ͨ��a mol CO2����ʱ����ǡ�û���D������aС��0.01
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�Ͼɵ�ز��ϵ���Ҫ�ɷ�Ϊ�����(LiCoO2)��������һ��������������ͭ��Ԫ�صĻ��������չ�����ͼ��ʾ�����տɵõ�Co2O3����Ρ�

��֪��CoC2O4��2H2O����ˮ�������ܽ�����¶����߶������������������C2O42����������Co(C2O4)n2(n��1)�����ܽ⡣
��1������ԭ����������У�LiCoO2������Ӧ�����ӷ���ʽΪ��___���ù����¶�ͨ��������40�����µ�ԭ���ǣ�___��
��2���������������̵������Լ������÷ֱ���___��___��
��3������ͭ�������Լ�XΪH2S����д���÷�Ӧ�����ӷ���ʽ��___�������������¸÷�Ӧ��ƽ�ⳣ��K��___����֪��25��ʱKap(CuS)��8.5��10��45����֪H2S��ˮ�еĵĵ��볣����K1��1.3��10��7��K2��7.l��10��15
��4�������ܡ������У�(NH4)2C2O4�ļ�����(ͼa)��������Ӧ���¶�(ͼb)���ܵij����ʹ�ϵ��ͼ��ʾ��

����n(C2O42��)��N(Co2��)��ֵ�����ӣ��ܵij������������������С��ԭ��___��
�ڳ�����Ӧʱ��Ϊ10 min���¶���50������ʱ�����¶����߶��ܵij������½��Ŀ���ԭ����___��
��5����֪����ﮡ������У���Һa�е�c(Li��)ԼΪ10��1mol��L��1��������ε��ܽ���������±���ʾ��

������ݷ�������﮹������õ��Լ�b��___(д��ѧʽ)����Ӧ�IJ�������������Һa�м����Թ������Լ�b�����裬___��___��ϴ�Ӹ���������ϴ���ķ�����___��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com