
【题目】有以下物质:
①石墨;②铝;③酒精;④氨水;⑤二氧化碳;⑥碳酸氢钠固体;⑦氯化铁溶液;⑧纯醋酸;⑨氧化钠固体;⑩氯化氢气体。
(1)其中能导电的是___;属于非电解质的是___;属于强电解质的是___;属于弱电解质的是___。
(2)写出物质⑥溶于水的电离方程式:____。
(3)写出物质⑥和⑧在水中反应的离子方程式:___。
(4)配制溶液⑦时通常将⑦先溶于___,然后再加水稀释,通过增加溶液中__的浓度以防止其发生水解。
(5)浓度、体积相同的⑧和⑩的溶液,加入相同形状且足量的Zn粒,反应速率快的是___(填化学式);pH值、体积相同的⑧和⑩的溶液时,产生气体的量多的是___。(填化学式)
【答案】①②④⑦ ③⑤ ⑥⑨⑩ ⑧ NaHCO3Na++HCO3-(HCO3-![]() H++CO32-) HCO3-+CH3COOHCH3COO-+CO2↑+H2O 盐酸 氢离子 HCl CH3COOH
H++CO32-) HCO3-+CH3COOHCH3COO-+CO2↑+H2O 盐酸 氢离子 HCl CH3COOH
【解析】
①石墨是单质,既不是电解质也不是非电解质,但是可以导电;②铝是单质,既不是电解质也不是非电解质,但是可以导电;③酒精是非电解质,不能导电;④氨水是一水合氨的水溶液,是混合物,既不是电解质也不是非电解质,但是可以导电;⑤二氧化碳是非电解质,也不能导电;⑥碳酸氢钠固体是强电解质,但是固体不导电;⑦氯化铁溶液是混合物,既不是电解质也不是非电解质,但是可以导电;⑧纯醋酸是弱电解质,纯净的醋酸不导电;⑨氧化钠固体是强电解质,但是固体不导电;⑩氯化氢气体是强电解质,但是气体不导电。
(1)根据分析,其中能导电的是①②④⑦;属于非电解质的是③⑤;属于强电解质的是⑥⑨⑩;属于弱电解质的是⑧;
(2)碳酸氢钠是强电解质,溶于水的电离方程式为NaHCO3Na++HCO3-,由于碳酸氢根离子是二元弱酸的酸式酸根离子,故可以发生第二步电离HCO3-![]() H++CO32-;
H++CO32-;
(3)醋酸的酸性强于碳酸,故⑥和⑧反应的方程式为HCO3-+CH3COOHCH3COO-+CO2↑+H2O;
(4)三价铁离子容易水解,故在配制其溶液时,应先将其溶解在浓盐酸中,抑制其水解,而后加水稀释到所要的浓度。
(5)同体积、同浓度的强酸和弱酸溶液,强酸电离出的氢离子比弱酸多,故加入相同形状且足量的Zn粒,反应速率快的是强酸,而pH相同的强酸和弱酸,弱酸的浓度要远大于强酸,故产生的气体也比强酸多,所以浓度、体积相同的⑧和⑩的溶液,加入相同形状且足量的Zn粒,反应速率快的是HCl,pH值、体积相同的⑧和⑩的溶液时,产生气体的量多的是CH3COOH。


科目:高中化学 来源: 题型:
【题目】如图的各方框表示一种反应物或生成物(某些物质已经略去),其中常温下A、C、D为无色气体,C能使湿润的红色石蕊试纸变蓝。
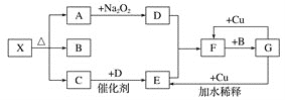
(1)写出物质X的化学式:__。
(2)写出下列变化的化学方程式:
①A→D:___;
②G→E:___;
③F→G:___。
(3)实验室里,常用加热固体混合物的方法制取气体C,请写出化学方程式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100mL的稀硝酸中加入由铜和镁组成的2.64g 混合物,两者恰好反应固体完全溶解时收集到0.896L(标准状态)NO气体。向反应后的溶液中加入60mLNaOH溶液中金属离子恰好沉淀完全。下列说法正确的是( )
A.原硝酸溶液的物质的量浓度为1.2mol/L
B.形成的沉淀的质量为4.32g
C.混合物中Cu的质量为1.92g
D.NaOH溶液的物质的量浓度为1mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的数值,下列说法正确的是( )
A.等物质的量的FeCl2与FeCl3,前者比后者少NA个氯离子
B.16g CH4和18g NH3所含质子数均为10NA
C.1mol过氧化钠与足量水反应时,转移电子的数目为2NA
D.常温常压下,相同体积的Cl2、HCl含有的分子数和原子数均相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A. 常温下,将pH=3的醋酸溶液加水稀释到原体积的10倍后,溶液的pH=4
B. 为确定某酸H2A是强酸还是弱酸,可测NaHA溶液的pH。若pH>7,则H2A是弱酸;若pH<7,则H2A是强酸
C. pH=13的NaOH溶液与pH=1的醋酸溶液等体积混合后所得溶液的pH>7
D. 向氨水中逐滴滴入盐酸至溶液的pH=7,则混合液中:c(NH4+) = c(Cl-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是不同温度下水的离子积常数:
温度/℃ | 25 | T1 | T2 |
水的离子积常数 | 1×10-14 | a | 1×10-12 |
试回答以下问题:
(1)若25℃<T1<T2,则a__________1×10-14(填“>”、“<”或“=”),做此判断的理由是______________________________________。
(2)25℃时,某Na2SO4溶液中c(SO42—)=5×10-4mol/L,取该溶液1 mL加水稀释至10 mL,则稀释后溶液中c(Na+)∶c(OH-)=__________。
(3)T2℃时,将pH=11的苛性钠溶液V1L与pH=1的稀硫酸V2L混合(设混合后溶液的体积为原两溶液体积之和),所得混合溶液的pH=2,则V1∶V2=__________。此溶液中各种离子的浓度由大到小的顺序是____________________________。
(4)常温下,设某pH值的硫酸中水电离出的c(H+)=1.0×10-amol/L,设相同pH值的硫酸铝中水电离出的c(H+)=1.0×10-bmol/L,(a、b都是小于14的正数),那么a、b之间满足的关系式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液,只含以下离子中的若干种:K+、NH4+、Ba2+、Cl﹣、NO3﹣、SO42﹣,现取三份100mL溶液分别进行如下实验:
①第一份加入稀硝酸无明显现象,再加入AgNO3溶液有沉淀产生
②第二份加足量NaOH溶液后加热,收集到气体0.04mol
③第三份加足量BaCl2溶液后,得沉淀4.66g,加盐酸,沉淀质量不变。
根据以上实验,回答下列问题:
(1)溶液中不能确定是否存在的离子是_____,一定存在的阴离子是_____
(2)实验③间接表明溶液中不存在的离子是_____,实验②发生反应的离子方程式为_____
(3)小明根据上述实验认为该溶液中一定存在的阳离子为NH4+和_____,判断的依据是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用CO 合成甲醇的化学方程式为CO(g)+2H2(g)![]() CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是
CH3OH(g) △H<0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是

A. 温度:T1>T2>T3 B. 正反应速率:v(a)>v(c),v(b)>v(d)
C. 平衡常数:K(a)>K(c)>K(b)>K(d) D. 平均摩尔质量:M(a)>M(c),M(b)>M(d)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示,在一个密闭的玻璃管两端各放一团棉花,再用注射器同时在两端注入适量的浓氨水和浓盐酸,下列说法不正确的是
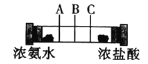
A.玻璃管中发生的反应可表示为:NH3+HCl=NH4Cl
B.实验时会在玻璃管的A处附近看到白雾
C.用手触摸玻璃管外壁,会感觉到有热量放出
D.将浓盐酸换成浓硝酸也会有相似现象
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com