
【题目】K2FeO4 在水中不稳定,发生反应:4FeO![]() +10H2O
+10H2O![]() 4Fe(OH)3(胶体)+8OH- +3O2
4Fe(OH)3(胶体)+8OH- +3O2![]() ,其稳定性与温度(T)和溶液 pH 的关系分别如图所示。下列说法正确的是
,其稳定性与温度(T)和溶液 pH 的关系分别如图所示。下列说法正确的是
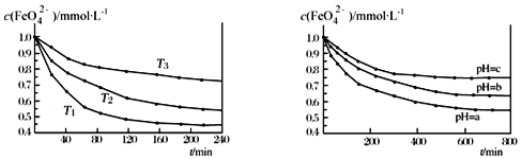
图 IK2FeO4 的稳定性与温度的关系 图 IIK2FeO4 的稳定性与溶液 pH 的关系
A.由图 I 可知 K2FeO4 的稳定性随温度的升高而升高B.由图 II 可知图中 a>c
C.由图 I 可知温度:T1>T2>T3D.由图 I 可知上述反应ΔH<0
【答案】C
【解析】
A.由图I数据可知,温度越高,相同时间内FeO42-浓度变化越快,则温度T1>T2>T3,温度越高FeO42-浓度越小说明K2FeO4的稳定性随着温度的升高而减弱,故A错误;
B.由题给方程式可知,增大氢氧根浓度,平衡向逆反应方向移动,FeO42-越稳定,结合图II可知,平衡时FeO42-浓度:a<c,则溶液pH:a<c,故B错误;
C.由图I数据可知,温度越高,相同时间内FeO42-浓度变化越快,则温度T1>T2>T3,故C正确;
D.由图I数据可知,温度越高,相同时间内FeO42-浓度变化越快,则温度T1>T2>T3,温度越高FeO42-浓度越小说明平衡向正反应方向移动,该反应为吸热反应,△H>0,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】可降解高分子化合物H的合成路线如下
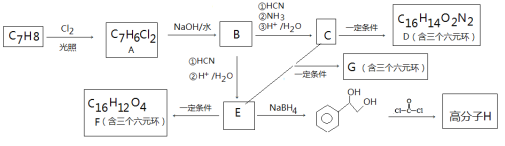
已知:i.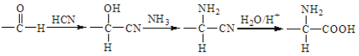
ii.![]() +2ROH
+2ROH ![]()
![]() +2HCl(R为烃基)
+2HCl(R为烃基)
回答下面问题:
(1)有机物C中含有官能团的名称________;
(2)有机物E生成F的反应类型_________;
(3)有机物D的结构简式_________,高分子化合物H的结构简式_________;
(4)具有相同官能团的有机物A的同分异构体有_________种;
(5)有机物E和C按1:1发生缩聚反应的化学方程式:__________;
(6)写出由乙烯合成多肽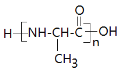 的合成路线图(其他无机试剂任选)____________。
的合成路线图(其他无机试剂任选)____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】水的电离平衡曲线如图所示,下列说法中,正确的是
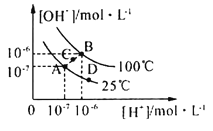
A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
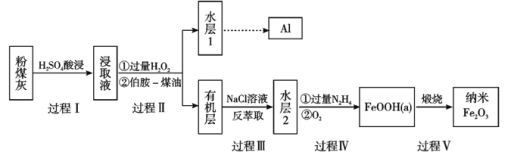
已知:
i)伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_____________。
(2)写出过程Ⅱ加入过量H2O2发生的离子方程式_____________。加入伯胺-煤油对浸取液进行分离,该操作的名称是_____________。
(3)从化学平衡角度解释过程Ⅲ利用NaCl溶液进行反萃取的原理_____________。
(4)过程Ⅳ中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_______________。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:
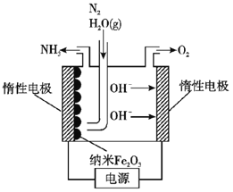
第一步:Fe2O3+3H2O+6e-=2Fe+6OH-;
第二步:2Fe+N2+3H2O=Fe2O3+2NH3。
则该电解池发生总反应的化学方程式为___________________________________,纳米Fe2O3在电解过程中所起的作用是___________________________________。
(6)某特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3),若x平均值为1.3,则磁流体中Fe3+和Fe2+的质量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中有可逆反应:![]() ;
;![]() 处于平衡状态
处于平衡状态![]() 已知
已知![]() ,则下列说法正确的是
,则下列说法正确的是![]()
①升温时![]() 的值减小②降压时体系内混合气体的平均相对分子质量减小③加入B,A的转化率变大④加入催化剂,气体的总物质的量不变⑤充入C,则A、B的物质的量增大
的值减小②降压时体系内混合气体的平均相对分子质量减小③加入B,A的转化率变大④加入催化剂,气体的总物质的量不变⑤充入C,则A、B的物质的量增大
A.③④B.①②⑤C.②③⑤D.全部
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式___________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为___________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量___________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O,6NO2+ 8NH3=7N2+12H2O;NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。计算:①该混合气体中NO与NO2的体积比____________。②吸收后氨水的物质的量浓度_______________(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
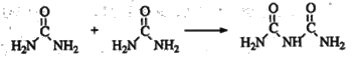 +NH3
+NH3
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)![]() 3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )

A.反应物A的浓度:a点小于b点
B.该反应的某种生成物可能对反应起催化作用
C.曲线上的c、d两点都表示达到平衡状态
D.A的平均反应速率:ab段大于bc段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,四种均为0.1molL﹣1的溶液,其pH如下表所示,下列关系不正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaHCO3 |
|
pH | 7.0 | 7.0 | 8.4 | 9.9 |
A.酸性:H2CO3>![]()
B.水电离产生的c(H+):①=②
C.溶液③中:c(HCO3-)+c(CO32-)+c(H2CO3)= 0.1molL﹣1
D.溶液④中:c(Na+)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】甲、乙两池电极材料都是铁棒与碳棒(如图),乙池箭头方向为电子移动方向。请回答:

(1)若两池中均盛放CuSO4溶液,反应一段时间后:
①有红色物质析出的是:甲池中的_________棒;乙池中的________棒。
②在乙池中阳极的电极反应是__________。
(2)若两池中均盛放滴加少量酚酞的饱和NaCl溶液。
①甲池中的铁容易发生腐蚀,该腐蚀属于电化学腐蚀中的_________腐蚀。
②测得乙池中有0.2mol电子发生转移,则标准状况下理论共有_________L气体生成。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com