
【题目】水的电离平衡曲线如图所示,下列说法中,正确的是
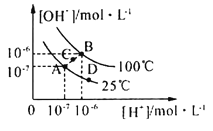
A.图中A、B、D三点处Kw的大小关系:B>A>D
B.25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,溶液中c(NH4+)/c(NH3·H2O)的值逐渐减小
C.在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系可从A点变化到C点
D.A点所对应的溶液中,可同时大量存在Na+、Fe3+、Cl-、SO42—
【答案】B
【解析】
A、Kw的影响因素为温度,水的电离吸热,升高温度Kw增大,A、D在同一等温线上,故图中A、B、D三点处Kw的大小关系为B>A=D,A错误;
B、25℃时,向pH=1的稀硫酸中逐滴加入pH=8的稀氨水,c(OH-)逐渐增大, c(OH-) c(NH4+) /c(NH3·H2O)的值不变,故c(NH4+) /c(NH3·H2O)逐渐减小,B正确;
C、在25℃时,保持温度不变,在水中加人适量NH4Cl固体,体系不能从A点变化到C点,体系从A点变化到C点,可采用加热的方法,C错误;
D、A点所对应的溶液呈中性,Fe3+因水解生成氢氧化铁沉淀不能大量存在,D错误。
故选B。


科目:高中化学 来源: 题型:
【题目】在下列物质转化中,A是一种正盐,D的相对分子质量比C的相对分子质量大16,E是酸,当X无论是强酸还是强碱时,都有如下的转化关系:
![]()
当X是强酸时,A、B、C、D、E均含同一种元素;当X是强碱时,A、B、C、D、E都含另外同一种元素。请回答:
(1)A是__________,Y是__________,Z是__________。
(2)当X是强酸时,E是__________;B生成C的化学方程式是________________________。
(3)当X是强碱时,E是__________; B生成C的化学方程式是________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】酸雨的主要成分是H2SO4,以下是形成途径之一:①NO2+SO2=NO+SO3,②2NO+O2=2NO2,③SO3+H2O=H2SO4,以下叙述错误的是
A. NO2由反应N2+2O2![]() 2NO2生成
2NO2生成
B. 总反应可表示为2SO2+O2+2H2O![]() 2H2SO4
2H2SO4
C. 还可能发生的反应有4NO2+O2+2H2O=4HNO3
D. 还可能发生的反应有4NO+3O2+2H2O=4HNO3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一种实验室制备次氯酸钠和氯酸钾的装置和步骤如下:
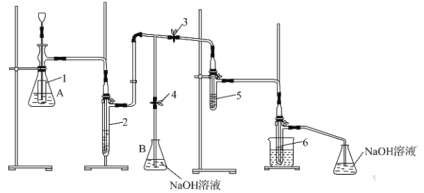
①如图组装装置,检查装置的气密性。②在锥形瓶A内放入5gKMnO4粉末,安全漏斗深入试管内部。在试管5中放入4mL6mol·L-1的KOH溶液,试管6中放入4mL2mol·L-1的NaOH溶液。③打开止水夹3,关闭止水夹4,控制试管5中温度在323~328K范围内,通过安全漏斗向锥形瓶A中缓缓加入15mL9mol·L-1的盐酸,并控制氯气均匀产生。④当试管5内由无色慢慢变为黄绿色,再由黄绿色突然变成无色时,继续通氯气至溶液呈极淡的黄色,停止加热。⑤。⑥将试管5拆下,冷水浴冷却至不再有晶体析出,过滤、洗涤、干燥。
回答下列问题:
(1)锥形瓶A内的小试管的作用是___。
(2)洗气瓶2内的试剂可以是___。
A.饱和氯化钙溶液 B.浓硫酸 C.饱和食盐水 D.饱和碳酸氢钠溶液
(3)控制试管5中温度在323~328K范围内,采取的加热方式是___。试管5因生成了KClO而显黄绿色,KClO的电子式为___。黄绿色突然变为无色是因为KClO分解生成了KClO3,写出KClO分解的化学方程式:___。
(4)步骤⑤的操作是___。
(5)步骤⑥中得到的晶体用乙醇洗涤的优点是___。
(6)取试管6中的液体少许于另一试管中,加入硫酸调至弱酸性,向其中滴加0.2mol·L-1的MnSO4溶液,有黑色沉淀生成,则发生反应的离子方程式为___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家开发设计一种天然气脱硫装置,利用如右图装置可实现:H2S+O2→H2O2 +S。已知甲池中有如下的转化:


下列说法错误的是:
A. 该装置可将光能转化为电能和化学能
B. 该装置工作时,溶液中的H+从甲池经过全氟磺酸膜进入乙池
C. 甲池碳棒上发生电极反应:AQ+2H+ +2e- =H2AQ
D. 乙池①处发生反应:H2S+I3- =3I-+S↓+2H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常利用SiO2 和碳反应来制取硅,写出反应的化学方程式___________________。
工业上还可以利用镁制取硅,反应为2Mg+SiO2 = 2MgO+Si,同时会发生副反应:2Mg + Si = Mg2Si。如图是进行Mg与SiO2反应的实验装置,试回答下列问题:

(1)由于O2和H2O(g)的存在对该实验有较大影响,实验中应通入气体X作为保护气,试管中的固体药品可选用________(填序号)。
a.石灰石 b.锌粒 c.纯碱
(2)实验开始时,必须先通一段时间X气体,再加热反应物,其理由是 ___________________________;当反应引发后,移走酒精灯,反应能继续进行,其原因是______________________。
(3)反应结束后,待冷却至常温时,往反应后的混合物中加入稀盐酸,可观察到闪亮的火星,产生此现象的原因是副产物Mg2Si遇盐酸迅速反应生成SiH4(硅烷)气体,然后SiH4自燃.用化学方程式表示这两个反应①________________________②___________________.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究CO2与CH4的反应使之转化为CO和H2,对减缓燃料危机,减少温室效应具有重要的意义。
(1)已知CH4(g)+CO2(g)![]() 2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J mol-1·K-1,该反应能自发进行的温度范围为____。
2CO(g)+2H2(g) △H=+248kJ·mol-1、△S=310J mol-1·K-1,该反应能自发进行的温度范围为____。
(2)在密闭恒容容器中通入物质的量浓度均为0.1 mol·L-1的CH4与CO2,在一定条件下发生反应CH4(g)+CO2(g)![]() 2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。
2CO(g)+2H2(g),测得CH4的平衡转化率与温度、压强的关系如图所示。

①工业生产时一般会选用P4和1250℃进行合成,请解释其原因___________。
②在压强为P3、1000℃的条件下,该反应5min时达到平衡点Y,则用CO表示该反应的速率为_____,该温度下,反应的平衡常数为_________(保留3位有效数字)。
(3)CO和H2在工业上还可以通过反应C(s)+H2O(g) ![]() CO(g)+H2 (g)来制取
CO(g)+H2 (g)来制取
①在恒温恒容下,如果从反应物出发建立平衡,可认定已达平衡状态的是________。
A.体系压强不再变化 B.H2、CO和H2O的物质的量之比为1:1:1
C.混合气体的密度保持不变 D.混合气体中H2O的百分含量保持不变
②在某体积可变的密闭容器中同时投入四种物质,2min时达到平衡,测得容器中有1mol H2O(g)、1mol CO(g)、2.2molH2(g)和足量的C(s),如果此时对体系加压,平衡向__________(填“正”或“逆”)反应方向移动,达到新的平衡后,气体的平均摩尔质量为__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知水在25 ℃和95 ℃时的电离平衡曲线如图所示:
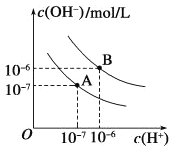
(1)25 ℃时水的电离平衡曲线应为__________ (填“A”或“B”)。
(2)95 ℃时水的离子积Kw=__________。
(3)25 ℃时,将pH=9的NaOH溶液与pH=4的H2SO4溶液混合,若所得混合溶液的pH=7,则NaOH溶液与H2SO4溶液的体积比为_____。
(4)95 ℃时,若100 mL pH1=a的某强酸溶液与1 mL pH2=b的某强碱溶液混合后,所得溶液呈中性,则混合前,该强酸的pH1与强碱的pH2之间应满足的关系是____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是

A. 离子半径的大小顺序:d<e<f
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com