
【题目】我国科学家开发设计一种天然气脱硫装置,利用如右图装置可实现:H2S+O2→H2O2 +S。已知甲池中有如下的转化:


下列说法错误的是:
A. 该装置可将光能转化为电能和化学能
B. 该装置工作时,溶液中的H+从甲池经过全氟磺酸膜进入乙池
C. 甲池碳棒上发生电极反应:AQ+2H+ +2e- =H2AQ
D. 乙池①处发生反应:H2S+I3- =3I-+S↓+2H+
【答案】B
【解析】
A.装置是原电池装置,据此确定能量变化情况;
B.原电池中阳离子移向正极;
C.甲池中碳棒是正极,该电极上发生得电子的还原反应;
D.在乙池中,硫化氢失电子生成硫单质,I3-得电子生成I-,据物质的变化确定发生的反应。
A.装置是原电池装置,根据图中信息知道是将光能转化为电能和化学能的装置,A正确;
B.原电池中阳离子移向正极,甲池中碳棒是正极,所以氢离子从乙池移向甲池,B错误;
C.甲池中碳棒是正极,该电极上发生得电子的还原反应,即AQ+2H++2e-=H2AQ,C正确;
D.在乙池中,硫化氢失电子生成硫单质,I3-得电子生成I-,发生的反应为H2S+I3-═3I-+S↓+2H+,D正确。
故合理选项是B。


 浙大优学小学年级衔接捷径浙江大学出版社系列答案
浙大优学小学年级衔接捷径浙江大学出版社系列答案科目:高中化学 来源: 题型:
【题目】取44.2g碳酸钠和碳酸氢钠的混合粉末样品,将其分成两等份,取其中一份加热到质量不再改变,冷却后称其质量为15.9g;另一份溶于水,配成500mL溶液。试计算(计算结果用小数形式表示):
(1)原样品中碳酸氢钠的物质的量为_____mol。
(2)所配溶液中Na+的物质的量浓度为______mol·L-1。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中国科学家用金属钠和CO2在一定条件下制得了金刚石:4 Na + 3CO2![]() 2 Na2CO3 + C(金刚石),以下是一些物质的熔沸点数据(常压):
2 Na2CO3 + C(金刚石),以下是一些物质的熔沸点数据(常压):
钠 | Na2CO3 | 金刚石 | 石墨 | |
熔点(℃) | 97.8 | 851 | 3550 | 3850 |
沸点(℃) | 882.9 | 1850(分解产生CO2) | ---- | 4250 |
(1)若反应在常压、890℃下进行,写出该反应的平衡常数表达式_____________________,若3v正(Na)=4v逆(CO2),则_____(选填序号)。
a.反应肯定达到平衡 b.反应可能达到平衡 c.反应肯定未达平衡
(2)若反应在10L密闭容器、常压下进行,5min内,测得金刚石的质量增加了6 g,该时间段内v(CO2)=______________,若反应温度由890℃升高到1860℃,则容器内气体的平均相对分子质量将________(选填“增大”、“减小”或“不变”) 。
(3)反应中还有石墨生成,已知:C(石墨)![]() C(金刚石),若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是_________反应(填“吸热”或“放热”)。
C(金刚石),若升高温度,生成的碳单质中,金刚石的含量将增大,则该反应的正反应是_________反应(填“吸热”或“放热”)。
(4)碳酸钠溶液中滴入盐酸的反应过程如右图所示,反应至A点时,未产生二氧化碳,请用离子方程式解释原因:_________________,继续滴加盐酸,反应至B点,B点溶液中溶质的化学式是__________。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量的Cl2通入一定浓度的苛性钾溶液中,两者恰好完全反应(已知反应过程放热),生成物中有三种含氯元素的离子,其中ClO-和ClO3-两种离子的物质的量(n)与反应时间(t)的变化示意图如图所示。下列说法不正确的是

A. Cl2和苛性钾溶液在不同温度下可能发生不同反应
B. 反应中转移电子数为是0.21 NA
C. 原苛性钾溶液中KOH的物质的量无法确定
D. 生成物中Cl- 的物质的量为 0.21 mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、M、N、W六种元素在周期表中的位置如图所示,下列说法不正确的是
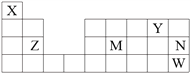
A. 原子半径:r(Z)>r(M)>r(Y)
B. 最高价氧化物对应水化物酸性:M>N
C. N的单质能与Z和W形成的化合物发生置换反应
D. X能与另五种元素形成化合物,且X的化合价不完全相同
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室从含碘废液(除H2O 外, 含有 CCl4、 I2、 I-等)中回收碘, 其操作流程如下:
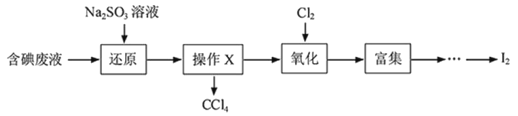
下列说法不正确的是:
A. 还原时,发生的主要反应为:SO32-+I2+H2O=SO42-+2I-+2H+
B. 加入 Na2SO3 溶液的目的是使碘元素进入水层
C. 操作X 的名称为萃取, 应在分液漏斗中操作
D. 氧化时,应控制在较低温度(40℃左右), 可增大 Cl2 的溶解度并减少 I2 的损失
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有A、B、C三种常见单质,其有关反应如图所示:

已知B、E的水溶液显酸性,E在一定条件下有还原性,但不能被浓H2SO4氧化,B显黄绿色,D遇KSCN溶液显血红色。
(1)写出B与水反应的离子方程式_______________________________
(2)A+B→D反应化学方程式___________________________________
(3)F→D的离子方程式是:____________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,NiS、FeS沉淀溶解平衡曲线如图所示(已知NiS的溶解度比FeS小,lg2=0.3),图中p(S2-)=-lgc(S2-)、p(M2+)=-lgc(M2+),M表示Ni或Fe,下列说法不正确的是

A. 曲线①表示的是NiS
B. d点分别对应的NiS和FeS的分散系均是均一稳定的
C. 25℃时,FeS+Ni2+![]() NiS+Fe2+的平衡常数K=4000
NiS+Fe2+的平衡常数K=4000
D. 向a点溶液中加入硫化钠,可变为b点溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向某密闭容器中加入 0.3 mol A、0.1 mol C 和一定量的 B 三种气体, 一定条件下发生如下反应: 3A(g) ![]() B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )
B(g)+2C(g),各物质的浓度随时间变化如图所示[t0~t1 阶段的 c(B)变化未画出]。下列说法中正确的是( )

A. 若 t1=15 s,则用 A 的浓度变化表示 t0~t1阶段的平均反应速率为 0.004 mol·L-1·s-1
B. t1时该反应达到平衡, A 的转化率为 60%
C. 该容器的容积为2 L,B的起始的物质的量为 0.02 mol
D. t0~t1 阶段, 此过程中容器与外界的热交换总量为 a kJ,该反应的热化学方程式为 3A(g)![]() B(g)+2C(g) ΔH=-50a kJ·mol-1
B(g)+2C(g) ΔH=-50a kJ·mol-1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com