
【题目】部分短周期元素原子半径的相对大小、最高正价或最低负价随原子序数的变化关系如图所示,下列说法正确的是

A. 离子半径的大小顺序:d<e<f
B. 与x形成简单化合物的沸点:y>z>d
C. 除去实验后试管中残留的g单质,可用热的氢氧化钠溶液
D. g、h的氧化物对应的水化物的酸性:h>g
科目:高中化学 来源: 题型:
【题目】下图是依据一定的分类标准,对某些物质与水反应情况进行分类的分类图。请根据你所学的知识,按要求填空:
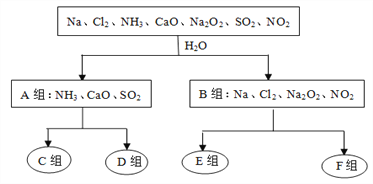
水溶液呈酸性 水溶液呈碱性 水作氧化剂 水既不作氧化剂也不作还原剂
(1)根据物质与水反应的情况,分成A、B组的分类依据是______________________________;
(2)A组中的CaO经常用作食品包装袋中的干燥剂,CaO所属的物质类别为____(填序号);
①金属氧化物 ②酸性氧化物 ③碱性氧化物 ④两性氧化物
(3)D组中的气体水溶液呈弱碱性,用电离方程式表示其水溶液呈弱碱性的原因:________________________________________________________________________________;
(4)F组中与水反应氧化剂与还原剂的之比是1:1的物质是______________(填化学式);
(5)SO2是形成酸雨的主要污染物,目前有一种较为有效的方法是在高空喷洒一种粉末状物质X,脱硫效果可达85%,其反应的化学方程式为:2X+2SO2+O2===2CaSO4+2CO2,由此可知X的化学式是_________;
(6)Cl2、Na2O2、SO2都能使品红褪色,其中漂白原理与其它两种物质不同的是_______________;将等物质的量的SO2、Cl2同时通入品红溶液中,实验现象是_________________________,产生该现象的原因是____________________________________(用化学方程式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在元素周期表中,元素的金属性和非金属性及其强弱比较与周期序数(n)和主族序数(A)有如下经验公式:K= ![]() (K为A与n的比值).下列推理正确的是( )
(K为A与n的比值).下列推理正确的是( )
A.当A一定时,K值越小,则元素的非金属性越强
B.当K=0,则该元素系同一周期中最活泼的金属元素
C.当n一定时,随着K值增大,则元素的非金属性逐渐增强
D.当K=l时,则该元素系过渡元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】N4分子结构为正四面体(如图所示)。已知:断裂N4(g)中1 molN-N键吸收193kJ能量,形成N2(g)中1 mol N![]() N放出941 kJ能量。下列说法正确的是
N放出941 kJ能量。下列说法正确的是
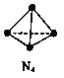
A. N4(g)比N2(g)更稳定
B. N4(g)=2N2(g) △H=+724kJmol-1
C. 形成1 mol N4(g)中的化学键放出193 kJ的能量
D. lmolN2(g)完全转化为N4(g),体系的能量增加362kJ
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________
该反应中氧化剂是_____;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】硫酸亚铁晶体(FeSO4·7H2O)在医药上作补血剂。某课外小组测定该补血剂中铁元素的含量,并检验该补血剂是否变质。实验步骤如下:
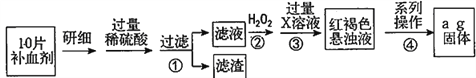
请回答下列问题:
(1)向操作①的滤液中滴加KSCN溶液后变为红色,则该滤液中含有______(填离子符号)。
(2)操作②中反应的离子方程式:__________________________________。
(3)操作③中反应的离子方程式:__________________________________。
(4)操作④中一系列处理的操作步骤:过滤、______、灼烧、_______、称量。
(5)假设实验中的损耗忽略不计,则每片补血剂含铁元素的质量为______g。(用含a的代数式表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】血红素中含有C、O、N、Fe五种元素.回答下列问题:
(1)C、N、O三种元素中电负性最小的是 . (填元素符号),写出基态Fe原子的核外电子排布式(简写) .
(2)如图1所示为血红蛋白和肌红蛋白的活性部分﹣﹣血红素的结构式.血红素中N原子的杂化方式有 , 在如图2的方框内用“→”标出Fe2+的配位键. 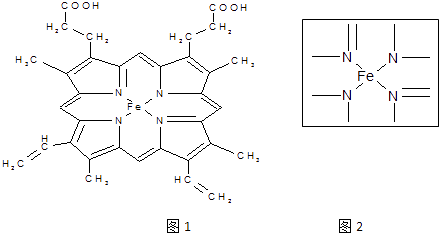
(3)NiO、FeO的晶体结构类型均与氯化钠的相同,Ni2+和Fe2+的离子半径分别为69pm和78pm,则熔点NiOFeO (填“<”或“>”).
(4)根据等电子原理,写出CN﹣的电子式 , 1mol O22+中含有的π键数目为 .
(5)铁有δ、γ、α三种同素异形体,γ晶体晶胞中所含有的铁原子数为 , δ、α两种晶胞中铁原子的配位数之比为 . 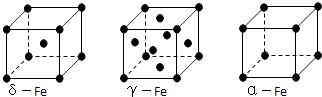
(6)现有两种组成皆为TiCl3.6H2O的晶体,其中 Ti3+的配位数均为6,但一种为紫色,
另一种为绿色.为测定这两种晶体的化学式,进行实验:
①两种配合物晶体各取1mol配成待测溶液;
②分别往待测溶液中滴入AgNO3溶液,均产生白色沉淀;
③沉淀完全后分别过滤、洗涤、干燥后称量,发现原紫色晶体的水溶液与AgNO3溶液反应得到的白色沉淀为3mol,绿色晶体的水溶液反应得到的白色沉淀为2mol.则绿色晶体的化学式为 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组同学在实验室用加热l﹣丁醇、浓H2SO4和溴化钠混合物的方法来制备1﹣溴丁烷,设计了如下图所示的实验装置(其中的夹持仪器没有画出). 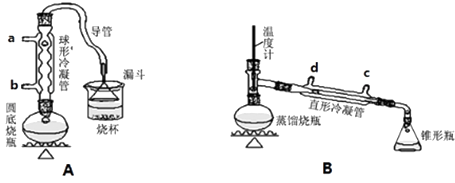
请回答下列问题:
(1)A装置中,在烧杯里的液面倒扣一个漏斗,其目的是 . 两个装置中都用到了冷凝管,A装置中冷水从(填字母代号)进入,B装置中冷水从(填字母代号)进入.
(2)制备操作中,加入的浓硫酸事先必须进行稀释,其目的是 . (填字母)
a.减少副产物烯和醚的生成 b.减少Br2的生成 c.水是反应的催化剂
(3)有同学拟通过红外光谱仪鉴定所得产物中是否含有“﹣CH2CH2CH2CH3”,来确定副产物中是否存在丁醚(CH3CH2CH2CH2OCH2CH2CH2CH3).请评价该同学设计的鉴定方案是否合理?为什么?答: .
(4)为了进一步提纯1﹣溴丁烷,该小组同学查得相关有机物的有关数据如下表:
物质 | 熔点/℃ | 沸点/℃ |
1﹣丁醇 | ﹣89.5 | 117.3 |
1﹣溴丁烷 | ﹣112.4 | 101.6 |
丁醚 | ﹣95.3 | 142.4 |
1﹣丁烯 | ﹣185.3 | ﹣6.5 |
则用B装置完成此提纯实验时,实验中要迅速升高温度至收集所得馏分.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com