
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________
该反应中氧化剂是_____;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________。
【答案】 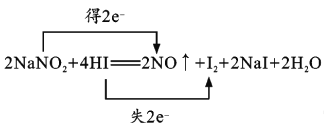 NaNO2 0.75NA D BC NO2-+Cl2+H2O=NO3-+2H++2Cl-
NaNO2 0.75NA D BC NO2-+Cl2+H2O=NO3-+2H++2Cl-
【解析】(1)反应中氮元素化合价从+3价降低到+2价得到1个电子,碘元素化合价从-1价升高到0价,失去1个电子,根据电子得失守恒可知用双线桥表示电子转移的方向和数目为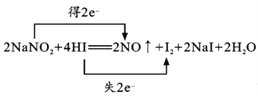 。该反应中氧化剂是NaNO2;若有0.75mol电子转移,则被还原的氧化剂是0.75mol,粒子数为0.75NA。(2)A. NaNO2会导致血红蛋白中的Fe2+转化为Fe3+,铁元素化合价升高,所以NaNO2被还原,作氧化剂,A正确;B. 可服用维生素C解毒,即维生素C可以把铁离子还原为亚铁离子,所以维生素C具有还原性,B正确;C.还原剂的还原性强于还原产物的还原性,则还原性:维生素C>Fe2+,C正确;D.NaNO2是氧化剂,D正确,答案选D。(3)A. 焰色反应均显黄色,不能区分,A错误;B.亚硝酸钠能把硫酸亚铁氧化为硫酸铁,所以分别滴加酸化FeSO4溶液和KSCN溶液可以区分,B正确;C.亚硝酸钠能把碘化钾氧化为单质碘,在酸性条件下加入KI淀粉溶液可以区分,C正确;D.分别滴加AgNO3溶液均产生白色沉淀,不能区分,D错误,答案选BC;(4)氯水褪色,同时生成NaNO3和HCl,说明亚硝酸钠被氧化,所以反应的离子方程式为NO2-+Cl2+H2O=NO3-+2H++2Cl-。
。该反应中氧化剂是NaNO2;若有0.75mol电子转移,则被还原的氧化剂是0.75mol,粒子数为0.75NA。(2)A. NaNO2会导致血红蛋白中的Fe2+转化为Fe3+,铁元素化合价升高,所以NaNO2被还原,作氧化剂,A正确;B. 可服用维生素C解毒,即维生素C可以把铁离子还原为亚铁离子,所以维生素C具有还原性,B正确;C.还原剂的还原性强于还原产物的还原性,则还原性:维生素C>Fe2+,C正确;D.NaNO2是氧化剂,D正确,答案选D。(3)A. 焰色反应均显黄色,不能区分,A错误;B.亚硝酸钠能把硫酸亚铁氧化为硫酸铁,所以分别滴加酸化FeSO4溶液和KSCN溶液可以区分,B正确;C.亚硝酸钠能把碘化钾氧化为单质碘,在酸性条件下加入KI淀粉溶液可以区分,C正确;D.分别滴加AgNO3溶液均产生白色沉淀,不能区分,D错误,答案选BC;(4)氯水褪色,同时生成NaNO3和HCl,说明亚硝酸钠被氧化,所以反应的离子方程式为NO2-+Cl2+H2O=NO3-+2H++2Cl-。


 口算题卡北京妇女儿童出版社系列答案
口算题卡北京妇女儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( ) 
A.在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ)
B.HA为弱酸
C.常温下,MA溶液的pH>7
D.N点水的电离程度小于K点水的电离程度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一恒容的密闭容器中充入 0.1mol/L CO2、0.1mol/L CH4 , 在一定条件下发生反应:CH4(g)+CO2(g)2CO(g)+2H2(g),测得CH4平衡时转化率与温度、压强关系如图,下列有关说法不正确的是( ) 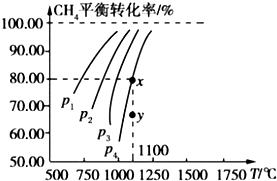
A.1100℃时该反应平衡常数为 1.64
B.压强:p4>p3>p2>p1
C.上述反应的△H<0
D.压强为 p4时,在y点:v 正>v 逆
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】2017年我国首艘使用了钛合金材料的国产航母下水。钛(Ti)常温下与酸、碱均不反应,但高温下能被空气氧化。由钛铁矿(主要成分是FeO和TiO2)提取金属钛的主要工艺流程如图,下列说法错误的是

A. 步骤I中碳作还原剂
B. 步骤II中未发生氧化还原反应
C. 步骤III需在氩气环境中进行,防止金属被空气氧化
D. 可用稀硫酸除去金属钛中的少量镁
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】SO2和NOx是主要的大气污染物。某小组认为一定条件下,用NH3与NO2反应转化为无污染物质可进行汽车尾气无害化处理。
(1)氨气的制备
①实验室制氨气的化学方程式为_________。
②制备和收集纯净、干燥的氨气,可以选择下图装置______(填序号),C中试剂为______。

(2)氨气与二氧化氮的反应(已知:2NO2+2NaOH=NaNO3+NaNO2+H2O。)
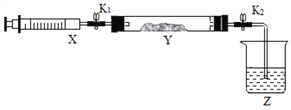
①在硬质玻璃管Y中加入少量催化剂,将NO2气体注入Y管中,Z中应盛装______。
②打开K1,将注射器X中的NH3缓慢注入Y中,发生反应的方程式为_______。
③将注射器活塞退回原处并固定,待装置恢复到室温,打开K2,Y中出现倒吸现象,原因是_________。
(3)该小组进一步研究SO2的性质,探究SO2能否与Na2O2发生氧化还原反应。实验室用铜丝和浓硫酸反应生成SO2的化学方程式为____________。利用(2)中装置,将Y中的药品更换为少量Na2O2,将注射器X中SO2缓慢推入Y中,Y装置中淡黄色粉末变成白色。设计方案检验生成的白色物质中含有SO42-_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.常温下,铝片与浓硝酸不反应
B.Fe(OH)2是灰绿色的难溶固体
C.用激光笔照射胶体可产生“丁达尔效应”
D.标准状况下,22.4L CCl4中含有的分子数为6.02×1023
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某溶液中只可能含有H+、NH4+、Mg2+、Al3+、Fe3+、CO32-、SO42-、NO3-、Br-中的几种。①若加入铝粉,产生的气体是H2;②若加入NaOH溶液,产生白色沉淀,且产生的沉淀量与加入NaOH的物质的量之间的关系如图所示。则:

(1)溶液中的阳离子一定含有__________,阴离子无法确定是否存在的是___________。
(2)O→A、C→D的离子方程式为:
O→A____________________________________。
C→D______________________________________。
(3)为确定上述阴离子是否含有,只需向原溶液中加入某试剂,并测定产生的沉淀质量即可。下列试剂符合要求的是_______。
A.AlCl3 B.NaOH C.Ba(OH)2 D.BaCl2
若加入足量上述所选试剂后,产生沉淀质量为46.6克,则上述溶液中所有的阴离子及其物质的量为:____________、_______________(没有就不填)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在透明溶液中能大量共存的是
A. H+、K+、NO3-、HCO3- B. Na+、Fe3+、K+、Cl-
C. Ca2+、H+、NO3-、CO32- D. Cu2+、Na+、OH-、SO42-
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com