
【题目】常温下,向100mL0.01mol/L的HA溶液中逐滴加入0.02mol/L的MOH溶液,图中所示曲线表示混合溶液的pH的变化情况,下列说法正确的是( ) 
A.在N到K间任意一点对应的溶液中:c(M+)+c(H+)=c(OHˉ)+c(Aˉ)
B.HA为弱酸
C.常温下,MA溶液的pH>7
D.N点水的电离程度小于K点水的电离程度
【答案】A
【解析】解:A.任何电解质溶液中都存在电荷守恒,根据电荷守恒得c(M+)+c(H+)=c(OHˉ)+c(Aˉ),故A正确; B.HA溶液的物质的量浓度为0.01mol/L,根据图知,未加NaOH溶液时HA的pH=2,溶液中c(H+)=c(HA),则HA是强电解质,为强酸,故B错误;
C.HA是强酸,混合溶液呈中性时M(OH)体积为51mL,MOH过量,说明MOH是弱电解质,MA是强酸弱碱盐,其水溶液呈酸性,pH<7,故C错误;
D.酸或碱抑制水电离,含有弱离子的盐促进水电离,N点溶质为MA和及少量MOH,K点溶质为等物质的量的MA和MOH,N点促进水电离、K抑制水电离,故D错误;
故选A.


 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案科目:高中化学 来源: 题型:
【题目】下列各项除杂所用方法正确的是 ( )
A. KCl固体混有KClO3:加少量二氧化锰固体并加热
B. CO2中混有CO气体:通入氧气中点燃
C. 硝酸钾溶液中混有氯化钠:加入四氯化碳萃取并分液
D. Cu(NO3)2溶液混有AgNO3:加入过量的铜粉并过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是自然賜给人类的宝藏,海水的综合利用是全世界研究的重点。
完成下列问题:
(1)粗盐中除了含有泥沙之外还含有Ca2+、Mg2+、SO42-等杂质,粗盐获得精盐一般步骤:

加入氯化钡、纯碱和烧碱的目的依次是:_________、_________、_________。
(2)海水提取金属镁流程如下:

流程中加入熟石灰目的__________;沉淀与盐酸反应的离子方程式_____________。
(3)某学生实验室模拟河水提取溴的步骤为:海水→浓缩→氧化→提取→溴
①氧化步骤:适宣作氧化剂的是_______。
ABr2 B.Cl2 C.I2 DHCl
②提取步骤:……溴水中加入CCl4振荡、静置……得溴的四氯化碳溶液,该分离提纯溴的方法叫________;用到的主要仪器为________。
(4)实验证明金属制品在海水中更容易生锈,铜锈的化学式为: ________;Cu与硫磺反应的化学方程式________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】I.一定量的CO(g)和H2O(g)分别通入容积为1L的恒容密闭容器中,发生反应CO(g)+H2OCO2(g)+H2(g)得到如下三组数据:
实验组 | 温度℃ | 起始量/mol | 平衡量/mol | 达到平衝所需时间/min | |
CO | H2O | CO2 | |||
1 | 500 | 8 | 4 | 3.2 | 4 |
2 | 700 | 4 | 2 | 0.8 | 3 |
3 | 700 | 4 | 2 | 0.8 | 1 |
(1)①下列情况表明反应达到平衡状态的是 (填序号)
A.CO2和H2生成速率相等
B.温度不变时,压强不变
C.生成CO2的速率和生成CO的速率相等
②实验2中,反应达到平衡状态时,CO的转化率为 .
③实验3和实验2相比,改变的条件是 .
(2)①硫化钠溶液具有较强碱性,其原因是(用离子方程式表示).
②欲使0.1mol的Na2S溶液中, ![]() 的值增大,可采取的措施是(填序号)
的值增大,可采取的措施是(填序号)
A.加适量等浓度的NaOH溶液
B.加适量的水
C.通入适量的H2S气体.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:反应①Fe(s)+CO2(g)FeO(s)+CO(g);△H=Q1 , 平衡常数为K1 , 反应②Fe(s)+H2O(g)FeO(s)+H2(g);△H=Q2 , 平衡常数为K2 ,
在不同温度下,K1、K2的值如下:
T(K) | K1 | K2 |
700 | 1.47 | 2.38 |
900 | 2.15 | 1.67 |
(1)从上表可推断,反应Q10(填“>”或“<”).
(2)现有反应③H2(g)+CO2(g)CO(g)+H2O(g);△H=Q3平衡常数为K3 . 根据反应①与②推导出K1、K2、K3的关系式K3= , Q1、Q2、Q3的关系式Q3= , 可推断反应③是(填“放”或“吸”)热反应.
(3)要使反应③在一定条件下建立的平衡右移,可采取的措施有 .
A.缩小容器体积
B.扩大容器的体积
C.降低温度E.升高温度
D.使用合适的催化剂
(4)如图甲、乙表示反应③在t1时刻达到平衡,在t2时刻因改变某个条件而发生变化的情况: 图甲中t2时刻改变的条件可能是 , 图乙中t2时刻改变的条件可能是 . 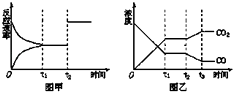
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有金属单质A、B、C和气体甲、乙、丙以及物质D、E、F、G、H,它们之间的相互转化关系如下图所示(图中有些反应的生成物和反应的条件没有标出)。

请回答下列问题:
(1)写出下列物质的化学式:B_________,丙_________,乙_________,H_________
(2)根据要求回答:
1)D溶液和F溶液在空气中混合的现象:_________________________________;
2)反应③离子方程式___________________________________________________;
3)反应⑦离子方程式___________________________________________________;
4)反应⑥化学方程式___________________________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 . A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在密闭容器中进行下列反应:M(气)+N(气)R(气)+2L(?)此反应符合下面图像,下列叙述正确的是( ) 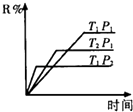
A.正反应放热,L是气体
B.正反应吸热,L是固体
C.正反应吸热,L是气体
D.正反应放热,L是固体或液体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某兴趣小组研究亚硝酸钠,查阅下列资料,试根据信息回答下列问题。
药品 | NaNO2(亚硝酸钠) |
性质 | 1.在酸性溶液中有较强氧化性,能将Fe2+氧化成Fe3+; 2.AgNO2是一种难溶于水、易溶于酸的盐。 |
(1)已知NaNO2能发生如下反应:2NaNO2+4HI=2NO↑+I2+2NaI+2H2O。请用双线桥表示电子转移的方向和数目。________________
该反应中氧化剂是_____;若有0.75mol电子转移,则被还原的氧化剂粒子数为_______。
(2)误食NaNO2会导致血红蛋白中的Fe2+转化为Fe3+而中毒,可服用维生素C解毒。下列分析错误的是______(填序号)。
A.NaNO2被还原 B.维生素C具有还原性
C.还原性:维生素C>Fe2+ D.NaNO2是还原剂
(3)下列方法中,可用来区分NaNO2和NaCl的是______ (填序号)。
A. 焰色反应 B.分别滴加酸化FeSO4溶液和KSCN溶液
C.在酸性条件下加入KI淀粉溶液 D.分别滴加AgNO3溶液
(4)某同学把新制的氯水加到NaNO2溶液中,观察到氯水褪色,同时生成NaNO3和HCl,请写出反应的离子方程式:_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com