
����Ŀ����ˮ����Ȼ�n������ı��أ���ˮ���ۺ�������ȫ�����о����ص㡣
�����������:
��1�������г��˺�����ɳ֮�����Ca2+��Mg2+��SO42-�����ʣ����λ�þ���һ�㲽��:

�����Ȼ�����������ռ��Ŀ��������:_________��_________��_________��
��2����ˮ��ȡ����þ��������:

�����м�����ʯ��Ŀ��__________�����������ᷴӦ�����ӷ���ʽ_____________��
��3��ijѧ��ʵ����ģ���ˮ��ȡ��IJ���Ϊ:��ˮ��Ũ������������ȡ����
����������:����������������_______��
ABr2 B.Cl2 C.I2 DHCl
����ȡ���裺������ˮ�м���CCl4������������������Ȼ�̼��Һ���÷����ᴿ��ķ�����________���õ�����Ҫ����Ϊ________��
��4��ʵ��֤��������Ʒ�ں�ˮ�и��������⣬ͭ��Ļ�ѧʽΪ: ________��Cu����Ƿ�Ӧ�Ļ�ѧ����ʽ________��
���𰸡� ��SO42- ��Ca2+��Ba2+ ��Mg2+ ʹMg2+���� Mg(OH)2+2H+=2H2O +Mg2+ B .��ȡ��Һ������ȡ�� ��Һ©�� Cu2(OH)2CO3 2Cu+S![]() Cu2S
Cu2S
����������1�������Ȼ�����Һ����ȥ��Һ�е�SO42-�����봿����Һ��ȥ��Һ��Ca2+��Ba2+�������ռ���Һ��ȥ��Һ�е�Mg2+����ȷ�𰸣���SO42- ����Ca2+��Ba2+�� ��Mg2+��
��2���Ѻ�ˮ��þ���ӱ�Ϊ������þ���������ڸ���þԪ�أ�������þ�����ᷴӦ�����Ȼ�þ��Һ��ˮ����ȷ�𰸣�ʹMg2+������Mg(OH)2+2H+=2H2O +Mg2+ ��
��3������������.Cl2>Br2>I2 > HCl�����˵�������ΪCl2�������ܹ�������������Ϊ�嵥������ȷѡ�B��
�� �����Ȼ�̼�������ˮ��Һ����ȡ��������������Ȼ�̼�У���ˮ�ֲ㣬���з�Һ���õ�������Ϊ��Һ©������ȷ�𰸣���ȡ��Һ������ȡ���� ��Һ©����
��4������ͭ��������������̼��ˮ�Ȼ�Ϸ�Ӧ���ɼ�ʽ̼��ͭ����ȷ����Cu2(OH)2CO3���������������ֻ�ܰ�ͭ����Ϊ+1��������ͭ������ȷ�Ӧ��������ͭ����ȷ�𰸣�2Cu+S![]() Cu2S��
Cu2S��


 ��������һ���þ�ϵ�д�
��������һ���þ�ϵ�д� Сѧ��10����Ӧ����ϵ�д�
Сѧ��10����Ӧ����ϵ�д�
| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��Һ�к���HCO3����SO32����Cl����Na+ �� ��������ͨ��������Cl2 �� ��Һ�������������ӵ�Ũ�Ȼ������ֲ�����ǣ� ��
A.HCO3��
B.SO32��
C.Cl��
D.Na+
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��A~J�dz����Ļ�ѧ���ʣ�ת����ϵ����ͼ��ʾ��A�������е�һ�ֵ�ζ����I��һ����;�㷺�Ľ�����������C��D��E��F��J��Ϊ���壬 H������Ԫ�ع��ɣ�Ħ������Ϊ41 g��mol��1��

��1��I�Ļ�ѧʽΪ________,H�Ļ�ѧʽΪ________��
��2��д����Ӧ�٢ڢۢܵĻ�ѧ����ʽ
��_______����________�� ��_______�� ��________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���±���Ԫ�����ڱ���һ���֣���Ա��е���������Ԫ�أ���д���пհף�
���� ���� | ��A | ��A | ��A | ��A | ��A | ��A | ��A |
2 | �� | �� | �� | �� | |||
3 | �� | �� | �� | �� |
��1��������������ˮ�����У�������ǿ�Ļ������������______��������ǿ�Ļ��������ѧʽ��_______��
��2���ݢ��γɻ�����ĵ���ʽ___�����γɵ����������Ľṹʽ____��
��3������������������������Ԫ����Ԫ�ط�����____��д������������������������������ˮ���ﷴӦ�����ӷ���ʽ________��
��4�����ĵ�������������������ˮ���ﷴӦ�����ӷ���ʽ��______��
��5�����������γ�ԭ����1��2��Һ̬������ף������ܽ����ĵ��ʣ��õ���ʽ��ʾ���γɹ��̣�____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijͬѧ����Ũ������ͭ��Ӧ��ʵ������У��۲쵽ͭƬ�����ڣ����ǶԺ�ɫ���ʵ���ɽ���ʵ��̽����
��1��������ͼ��ʾװ�ý���ʵ��1�������Ⱥͼг���������ȥ��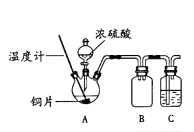
ʵ��1��ͭƬ��Ũ���ᷴӦ
���� | ���� |
���ȵ�120��~250�� | ͭƬ�����ڣ��д�������������γ�ī��ɫ��Һ |
����������338�� | ͭƬ�Ϻ�ɫ��ʧ��ƿ�г��֡�����������Һ�Դ���ɫ��ƿ�ײ��н϶�Ұ�ɫ���� |
��װ��B����������װ��C��ʢ�ŵ��Լ�����
��Ϊ֤��Aװ���лҰ�ɫ��������Ҫ�ɷ�Ϊ����ͭ��ʵ���������������
��2��̽��ʵ��1��120��~250��ʱ���ú�ɫ����ijɷ֡�
��������롿��ɫ�����п��ܺ���CuO��CuS��Cu2S�е�һ�ֻ��֡�
���������ϡ�
����1�������軯��[K4Fe(CN��6]��Cu2+����������������Cu2+����Һ�еμ������軯����Һ�����ɺ���ɫ������
����2��
CuS | Cu2S |
��ɫ�ᾧ���ĩ | �Һ�ɫ�ᾧ���ĩ |
������ϡ����������������Ũ��ˮ���ȵ�Ũ���� | ������ϡ�����Ũ����������������Ũ��ˮ |
����Ʋ�ʵʩʵ�顿
ʵ��2.̽����ɫ�������Ƿ�CuO
���� | ���� |
i.ȡ���渽�ź�ɫ�����ͭƬ5Ƭ������ˮϴ�ɾ�������ʢ��10mL�Լ�A��С�ձ��У����� | ��ɫ�������䣬¶��������ͭƬ |
ii.ȡ��ͭƬ������ɫ�������� | �ϲ���Һ���塢��ɫ |
���Լ�A����
�ڼ���Ϊii����Һ��ɫ�п�����Cu2+Ũ��̫С�����Dz���ʵ��ȷ������Һ�в���Cu2+ �� �����ʵ���������������
ʵ��3.̽����ɫ�������Ƿ�CuS��Cu2S
���� | ���� |
i.ȡʵ��2�к�ɫ������������������Ũ��ˮ������ | �й���ʣ�࣬��Һ�ֽ��߸�������Һ��dz��ɫ |
ii.��ȡʵ��2�к�ɫ������������������Ũ���ᣬ�Ⱥ��� | �й���ʣ�࣬��Һ���dz��ɫ |
����ý��ۡ���ʵ��2��ʵ��3�ɵõ��Ľ����ǣ�ʵ��1�У�120��~250��ʱ���ú�ɫ��������
��ʵ�鷴˼��
����ʵ��1��338��ʱ���������ԭ��ͬѧ����Ϊ�ǽϵ��¶�ʱ�����ĺ�ɫ�������ȵ�Ũ�����һ����Ӧ��ɡ���֪��Ӧ�ĺ���������ˮ����ͭ��ж����������ɫ������ʧʱ���ܷ��������з�Ӧ�Ļ�ѧ����ʽΪ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��Ϊ����Ư�۾����������ã���õķ�����
A.��ˮ�ܽ�B.��������ϡ����C.�����ʹ��D.����NaOH��Һ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����з�Ӧһ������������ԭ��Ӧ���ǣ� ��
A.���Ϸ�Ӧ
B.�û���Ӧ
C.�ֽⷴӦ
D.���ֽⷴӦ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������£���100mL0.01mol/L��HA��Һ����μ���0.02mol/L��MOH��Һ��ͼ����ʾ���߱�ʾ�����Һ��pH�ı仯���������˵����ȷ���ǣ� �� 
A.��N��K������һ���Ӧ����Һ�У�c��M+��+c��H+��=c��OH����+c��A����
B.HA����
C.�����£�MA��Һ��pH��7
D.N��ˮ�ĵ���̶�С��K��ˮ�ĵ���̶�
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����һ���ݵ��ܱ������г��� 0.1mol/L CO2��0.1mol/L CH4 �� ��һ�������·�����Ӧ��CH4��g��+CO2��g��2CO��g��+2H2��g�������CH4ƽ��ʱת�������¶ȡ�ѹǿ��ϵ��ͼ�������й�˵������ȷ���ǣ� �� 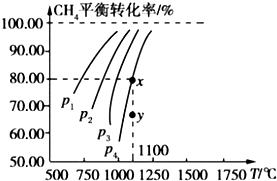
A.1100��ʱ�÷�Ӧƽ�ⳣ��Ϊ 1.64
B.ѹǿ��p4��p3��p2��p1
C.������Ӧ�ġ�H��0
D.ѹǿΪ p4ʱ����y�㣺v ����v ��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com