
【题目】A~J是常见的化学物质,转化关系如下图所示。A是生活中的一种调味剂,I是一种用途广泛的金属,常温下C、D、E、F、J皆为气体, H由两种元素构成,摩尔质量为41 g·mol-1。

(1)I的化学式为________,H的化学式为________。
(2)写出反应①②③④的化学方程式
①_______;②________; ③_______; ④________。
【答案】 Al AlN 2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑ 2NaOH+2Al+2H2O=2NaAlO2+3H2↑ NH3+AlCl3=AlN+3HCl 2Al+3Cl2
2NaOH+H2↑+Cl2↑ 2NaOH+2Al+2H2O=2NaAlO2+3H2↑ NH3+AlCl3=AlN+3HCl 2Al+3Cl2![]() 2AlCl3
2AlCl3
【解析】试题分析:A是生活中的一种调味剂,电解A的水溶液生成B、C、D三种物质,所以A是NaCl;B、C、D是氢气、氯气、氢氧化钠中的一种,C、D是气体,所以B是NaOH;根据C与J在高温、高压、催化剂的条件下生成F,可知C是H2、J是N2、F是NH3,则D是Cl2;氢气与氯气点燃生成氯化氢,则E是HCl;I是一种用途广泛的金属,氢氧化钠与I反应放出氢气,所以I是Al;氯气和铝点燃生成氯化铝,则G是AlCl3;氨气、氯化铝反应生成HCl和H,H由两种元素构成,摩尔质量为41 g·mol-1,所以H是AlN。
解析:根据以上分析,(1)I是铝,化学式为Al,H是AlN。
(2)①是电解食盐水生成氢氧化钠、氢气、氯气,方程式是2NaCl+2H2O ![]() 2NaOH+H2↑+Cl2↑;②是氢氧化钠与铝反应生成偏铝酸钠和氢气,反应方程式是2NaOH+2Al+2H2O=2NaAlO2+3H2↑; ③是氨气和氯化铝反应生成氯化氢和氮化铝,方程式是NH3+AlCl3=AlN+3HCl; ④是铝和氯气点燃生成氯化铝,反应方程式是2Al+3Cl2
2NaOH+H2↑+Cl2↑;②是氢氧化钠与铝反应生成偏铝酸钠和氢气,反应方程式是2NaOH+2Al+2H2O=2NaAlO2+3H2↑; ③是氨气和氯化铝反应生成氯化氢和氮化铝,方程式是NH3+AlCl3=AlN+3HCl; ④是铝和氯气点燃生成氯化铝,反应方程式是2Al+3Cl2![]() 2AlCl3。
2AlCl3。


科目:高中化学 来源: 题型:
【题目】取5.48gNa2CO3和NaHCO3的混合物溶于水配成200mL溶液,将溶液分成两等份。
(1)往其中一份溶液中加入300mLBa(OH)2溶液时,恰好使生成白色沉淀的量最多,测得反应后溶液的c(OH-)=0.100mol·L-1 (混合溶液体积改变忽略不计),则原混合物中n(Na2CO3) : n(NaHCO3)=。
(2)往另一份溶液中缓慢滴加0.l00mol·L-1盐酸,当加入的盐酸体积为300mL时,则收集到的CO2气体在标准状况下的体积为L(不考虑CO2在水中的溶解)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各项除杂所用方法正确的是 ( )
A. KCl固体混有KClO3:加少量二氧化锰固体并加热
B. CO2中混有CO气体:通入氧气中点燃
C. 硝酸钾溶液中混有氯化钠:加入四氯化碳萃取并分液
D. Cu(NO3)2溶液混有AgNO3:加入过量的铜粉并过滤
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】若甲烷与氯气以物质的量之比1:1混合,在光照下得到的有机取代产物是( ) ①CH3Cl、②CH2C12、③CHCl3、④CCl4 .
A.只有①
B.只有③
C.①②③的混合物
D.①②③④的混合物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】合成氨是人类科学技术上的一项重大突破,是化学和技术对社会发展与进步的巨大贡献之一.在制取合成氨原料气的过程中,常混有一些杂质,如CO会使催化剂中毒.除去CO的化学反应方程式(HAc表示醋酸):Cu(NH3)2Ac+CO+NH3═Cu(NH3)3(CO)Ac. 请回答下列问题:
(1)C,N,O的第一电离能由大到小的顺序为 .
(2)写出基态Cu+的核外电子排布式 .
(3)配合物Cu(NH3)3(CO)Ac中心原子的配位数为
(4)写出与CO互为等电子体的离子: . (任写一个)
(5)某化合物的晶胞如图所示,写出该化合物的化学式 , 距离每个X+最近的Cl﹣的个数为 . 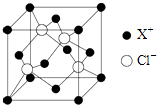
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某课外活动小组欲利用CuO与NH3反应,研究NH3的某种性质并测定其组成,设计了如下实验装置(夹持装置未画出)进行实验。请回答下列问题:
(1) 仪器a的名称为________;仪器b中可选择的试剂为________;
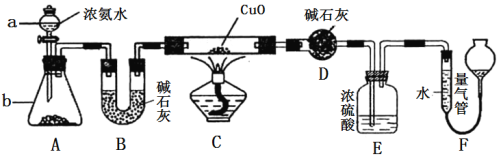
(2)实验室中利用下列各组物质,进行喷泉实验,不能成功的是 。
A.Cl2与饱和食盐水 B.CO2 与40%的NaOH溶液
C.NH3与饱和食盐水 D.HCl与水
(3)实验中观察到装置C中黑色CuO粉末变为红色固体,量气管有无色无味的气体,上述现象证明NH3具有________性,写出相应的化学方程式 。
(4)E装置中浓硫酸的作用________________________________。
(5)实验完毕,若测得干燥管D增重mg,装置F测得气体的体积为nL(已折算成标准状况),则氨分子中氮、氢的原子个数比为________(用含m、n字母的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水是自然賜给人类的宝藏,海水的综合利用是全世界研究的重点。
完成下列问题:
(1)粗盐中除了含有泥沙之外还含有Ca2+、Mg2+、SO42-等杂质,粗盐获得精盐一般步骤:

加入氯化钡、纯碱和烧碱的目的依次是:_________、_________、_________。
(2)海水提取金属镁流程如下:

流程中加入熟石灰目的__________;沉淀与盐酸反应的离子方程式_____________。
(3)某学生实验室模拟河水提取溴的步骤为:海水→浓缩→氧化→提取→溴
①氧化步骤:适宣作氧化剂的是_______。
ABr2 B.Cl2 C.I2 DHCl
②提取步骤:……溴水中加入CCl4振荡、静置……得溴的四氯化碳溶液,该分离提纯溴的方法叫________;用到的主要仪器为________。
(4)实验证明金属制品在海水中更容易生锈,铜锈的化学式为: ________;Cu与硫磺反应的化学方程式________;
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在80℃时,将0.4mol的四氧化二氮气体充入2L已抽空的固定容积的密闭容器中,隔一段时间对该容器内的物质进行分析,得到如下数据:反应进行至100s后将反应混合物的温度降低,发现气体的颜色变浅.
时间(s) | 0 | 20 | 40 | 60 | 80 | 100 |
C(N2O4) | 0.20 | a | 0.10 | c | d | e |
C(NO2) | 0.00 | 0.12 | b | 0.22 | 0.22 | 0.22 |
(1)该反应的化学方程式为 , 表中bc(填“<”、“=”、“>”).
(2)20s时,N2O4的浓度为mol/L,0~20s内N2O4的平均反应速率为 .
(3)该反应的平衡常数表达式K= , 在80℃时该反应的平衡常数K值为(保留2位小数).
(4)在其他条件相同时,该反应的K值越大,表明建立平衡时 . A、N2O4的转化率越高 B、NO2的产量越大
C、N2O4与NO2的浓度之比越大 D、正反应进行的程度越大.
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com