
【题目】氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式___________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为___________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量___________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O,6NO2+ 8NH3=7N2+12H2O;NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。计算:①该混合气体中NO与NO2的体积比____________。②吸收后氨水的物质的量浓度_______________(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
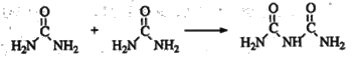 +NH3
+NH3
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比__________。
【答案】HN3 4.48 64 kg 9:1 2.4 mol/L 3:1:1
【解析】
(1)利用氢化物的相对分子质量直接求出组成该氢化物两种元素的原子数,而后求得分子式;N原子数=![]() =3,H原子数=
=3,H原子数=![]() =1,故分子式为HN3.因为该氢化物分解生成两种气体都是双原子分子,根据N原子、H原子守恒可求得混合气体体积;
=1,故分子式为HN3.因为该氢化物分解生成两种气体都是双原子分子,根据N原子、H原子守恒可求得混合气体体积;
(2)依题意知N2H4被氧化生成H2O,根据氢元素守恒可求得N2H4质量;
(3)①根据N原子守恒可求得参加反应的氨的物质的量,根据氧化还原反应中得失电子守恒可求得NO与NO2的物质的量;
②根据质量守恒可求得反应后溶液质量,进而求得溶液的体积和溶液的浓度;
(4) 三聚物有两种情况,一种为链状缩合时每生成一个三聚物同时生成2个氨气,一种为环状缩合时每生成一个三聚物同时生成3个氨气,根据质量守恒计算。
(1)氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,则氢原子的质量分数为0.023,则n(N):n(H)=![]() :
:![]() =3:1,所以最简式为HN3,设化学式为(HN3)n,有(1+14×3)n=43,n=1,所以分子式为HN3,4.30g该氢化物的物质的量为n=
=3:1,所以最简式为HN3,设化学式为(HN3)n,有(1+14×3)n=43,n=1,所以分子式为HN3,4.30g该氢化物的物质的量为n=![]() =0.1mol,根据反应2HN3═H2+3N2,共产生气体的物质的量为0.1mol×2=0.2mol,体积为0.2mol×22.4L/mol=4.48L;
=0.1mol,根据反应2HN3═H2+3N2,共产生气体的物质的量为0.1mol×2=0.2mol,体积为0.2mol×22.4L/mol=4.48L;
(2)反应的方程式为:2N2H4+N2O4═3N2+4H2O,生成72.0kg水时,n(H2O)=![]() =4000mol,则消耗的n(N2H4)=2000mol,联氨的质量为2000mol×32g/mol=64000g,即64kg;
=4000mol,则消耗的n(N2H4)=2000mol,联氨的质量为2000mol×32g/mol=64000g,即64kg;
(3)①根据N原子守恒可求得参加反应的氨的物质的量:n(NH3)+180mol=156mol×2,n(NH3)=132mol;根据氧化还原反应中得失电子守恒可求得NO与NO2的物质的量,设为NO的物质的量x,NO2的物质的量为(180mol-x),132mol×3=xmol×2+(180-x)mol×4,x=162mol,(180mol-x)=18mol,则NO与NO2体积比为162:18=9:1;
②根据质量守恒可求得反应后溶液质量=8.90×103g+162mol×30gmol-1+18mol×46gmol-1-156mol×28gmol-1=10220g,其溶液体积为![]() =10428cm3=10428mL=10.428L,反应后溶液中剩余溶质氨的物质的量是
=10428cm3=10428mL=10.428L,反应后溶液中剩余溶质氨的物质的量是![]() -132mol=25.058mol,则吸收后氨水的物质的量浓度为
-132mol=25.058mol,则吸收后氨水的物质的量浓度为![]() =2.4 molL-1;
=2.4 molL-1;
(4)三聚物有两种情况,一种为链状缩合时每生成一个三聚物同时生成2个氨气,一种为环状缩合时每生成一个三聚物同时生成3个氨气,根据二聚物物质的量分数为0.6,则三聚物的物质的量分数为0.4,设二聚物的物质的量为x,链状三聚物的物质的量为y,环状三聚物的物质的量为z,则有2x+3y+3z=120,x+2y+3z=80,x:(y+z)=3:2,解之得x=30mol,y=10mol,z=10mol,缩合产物中各缩合物的物质的量之比为3:1:1。


科目:高中化学 来源: 题型:
【题目】等质量的铁与过量的盐酸在不同的实验条件下进行反应,测定在不同时间(t)产生氢气体积(V)的数据,根据数据绘制如图,则曲线a、b、c、d所对应的实验组别可能是( )

组别 | c(HCl)/(molL-1) | 温度/℃ | 状态 |
1 | 2.0 | 25 | 块状 |
2 | 2.5 | 30 | 块状 |
3 | 2.5 | 50 | 粉末状 |
4 | 2.5 | 30 | 粉末状 |
A.④—③—②—①B.①—②—③—④
C.③—④—②—①D.①—②—④—③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上通常采取CO(g)和H2(g)合成CH3OH(g)
(1)已知某温度和压强下
①2CO(g)+O2(g)=2CO2(g) △H=-566kJ·mol-1
②2H2(g)+O2(g)=2H2O(g) △H=-483.6kJ·mol-1
③2CH2OH(g)+3O2(g)=2CO2(g)+4H2O(g) △H=-1275.6kJ·mol-1
则在相同温度和压强下,CO(g)与H2(g)合成CH3OH(g)的热化学方程式__________。若反应生成6.4g甲醇,则转移电子的物质的量为__________。
(2)可利用甲醇燃烧反应设计一个燃料电池。如图1,用Pt作电极材料,用氢氧化钾溶液作电解质溶液,在两个电极上分别充入甲醇和氧气。
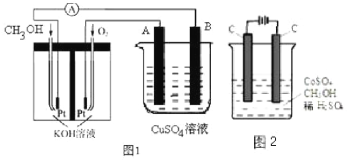
①写出燃料电池负极的电极反应式__________。
②若利用该燃料电池提供电源,与图1右边烧杯相连,在铁件表面镀铜,则铁件应是__________极(填“A”或“B”);当铁件的质量增重6.4g时,燃料电池中消耗氧气的标准状况下体积为__________L。
(3)电解法可消除甲醇对水质造成的污染,原理是:通电将Co2+氧化成Co3+,然后将甲醇氧化成CO2和H+(用石墨烯除去Co2+)现用如图2所示装置模拟上述过程,则Co2+在阳极的电极反应式为__________。除去甲醇的离子方程式为__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:(A)O2和O3;(B)23592U和23892U;(C) CH3CH2CH2CH3和 ;(D)
;(D) 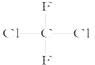 和
和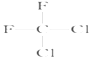 ;(E)甲烷和新戊烷。
;(E)甲烷和新戊烷。
(1)__________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)__________组两物质互为同系物;
(4)__________组两物质互为同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】K2FeO4 在水中不稳定,发生反应:4FeO![]() +10H2O
+10H2O![]() 4Fe(OH)3(胶体)+8OH- +3O2
4Fe(OH)3(胶体)+8OH- +3O2![]() ,其稳定性与温度(T)和溶液 pH 的关系分别如图所示。下列说法正确的是
,其稳定性与温度(T)和溶液 pH 的关系分别如图所示。下列说法正确的是
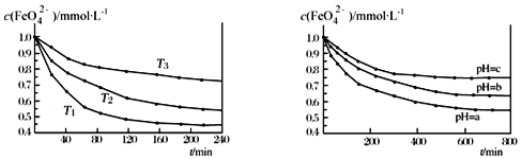
图 IK2FeO4 的稳定性与温度的关系 图 IIK2FeO4 的稳定性与溶液 pH 的关系
A.由图 I 可知 K2FeO4 的稳定性随温度的升高而升高B.由图 II 可知图中 a>c
C.由图 I 可知温度:T1>T2>T3D.由图 I 可知上述反应ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子组在指定的溶液中能够大量共存的是
A.无色溶液中:Cu2+、K+、SCN、Cl
B.pH=11的NaOH 溶液中:CO![]() 、Na+、NO
、Na+、NO![]() 、SO
、SO![]()
C.由水电离出的 c(H+)=1.0×1013 mol·L1 的溶液中:Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
D.含有NO![]() 的溶液中:I- 、SO
的溶液中:I- 、SO![]() 、SO
、SO![]() 、H+
、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】室温时,向 20 mL 0.1 mol·L 1 的两种酸 HA、HB 中分别滴加0.1 mol·L 1 NaOH 溶液, 其 pH 变化分别对应下图中的 I、II。下列说法不正确的是( )
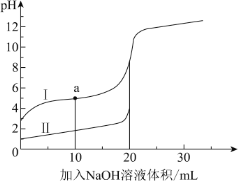
A.向 NaA 溶液中滴加 HB 可产生 HA
B.滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)=c(B-)
C.a 点,溶液中微粒浓度:c(A-) > c(Na+)
D.滴加 20 mL NaOH 溶液时,I 中 H2O 的电离程度大于 II 中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在密闭容器中发生如下反应:N2O4(g)![]() 2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
2NO2(g) △H>0,反应达到平衡时,下列说法不正确的是 ( )
A.若缩小容器的体积,则容器中气体的颜色先变深后又变浅,且比原平衡颜色深
B.若压强不变,向容器中再加入一定量的N2O4,再次达到平衡时各种物质的百分含量不变
C.若体积不变,向容器中再加入一定量的N2O4,平衡向逆反应方向移动,再次平衡时N2O4的体积分数将增大
D.若体积不变,升高温度,再次平衡时体系颜色加深
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、R、W是5种短周期元素,原子序数依次增大;它们可组成离子化合物Z2Y和共价化合物RY3、XW4;已知Y、R同主族,Z、R、W同周期。下列说法正确的是
A. 简单离子半径R>W>Y>Z
B. 气态氢化物稳定性:HmW<HnR
C. Z2Y2电子式可表示为![]()
D. RY2和W2均有漂白性,将两者等物质的量混合溶于水,漂白性增强
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com