
【题目】有下列各组物质:(A)O2和O3;(B)23592U和23892U;(C) CH3CH2CH2CH3和 ;(D)
;(D) 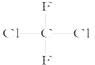 和
和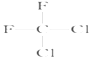 ;(E)甲烷和新戊烷。
;(E)甲烷和新戊烷。
(1)__________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)__________组两物质互为同系物;
(4)__________组两物质互为同分异构体。
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,2NO(g)+O2(g)![]() 2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )

A. a点B. b点C. c点D. d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| 700 | 800 | 830 |
|
|
K |
|
|
|
|
|
下列有关叙述不正确的是![]()
![]()
A.该反应的化学方程式是![]()
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入![]() 和
和![]() 各
各![]() ,
,![]() 内温度升高到
内温度升高到![]() ,测得此时
,测得此时![]() 为
为![]() 时,推知此时反应为平衡状态
时,推知此时反应为平衡状态
D.如果平衡浓度符合关系式![]() ,判断此时的温度是
,判断此时的温度是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
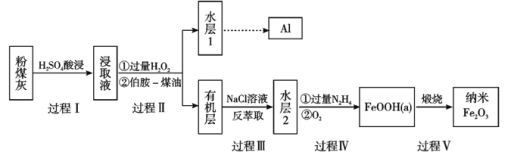
已知:
i)伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_____________。
(2)写出过程Ⅱ加入过量H2O2发生的离子方程式_____________。加入伯胺-煤油对浸取液进行分离,该操作的名称是_____________。
(3)从化学平衡角度解释过程Ⅲ利用NaCl溶液进行反萃取的原理_____________。
(4)过程Ⅳ中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_______________。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:
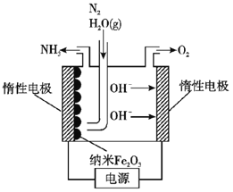
第一步:Fe2O3+3H2O+6e-=2Fe+6OH-;
第二步:2Fe+N2+3H2O=Fe2O3+2NH3。
则该电解池发生总反应的化学方程式为___________________________________,纳米Fe2O3在电解过程中所起的作用是___________________________________。
(6)某特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3),若x平均值为1.3,则磁流体中Fe3+和Fe2+的质量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜钴矿石主要含有CoOOH、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
I.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡,过滤,分离除去沉淀a。
II.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀b[主要成分是Na2Fe6(SO4)4(OH)12]。
III.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀c。
IV.III中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃ 煅烧,即得到Co2O3。
请回答:
(1)I 中,沉淀a的成分是_____,稀硫酸溶解CoCO3的化学方程式是_____, 加入Na2SO3溶液的主要作用是_________。
(2)根据图1、图2

①矿石粉末浸泡的适宜条件应是:温度_____、pH_____。
②图2中铜、钴浸出率下降的可能原因是_____。
(3)II中,浸出液中的金属离子与NaClO3反应的离子方程式:ClO![]() +_____+_____== Cl- +_____+ _____
+_____+_____== Cl- +_____+ _____
(4)I中,检验铁元素完全除去的试剂是_____,实验现象是_____。
(5)I中,沉淀c的成分是CaF2、_____(填化学式)。
(6)V中,加入Na2CO3的作用是_____。
(7)V中,分离出纯净的CoC2O4·2H2O的操作是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式___________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为___________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量___________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O,6NO2+ 8NH3=7N2+12H2O;NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。计算:①该混合气体中NO与NO2的体积比____________。②吸收后氨水的物质的量浓度_______________(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
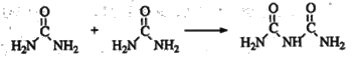 +NH3
+NH3
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1 和C2)、电源适配器和水瓶组装如图所示的装置。接通电源观察到:C1 周围产生细小气泡,C2 周围无明显现象;持续通电一段时间后,C2 周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。关于该实验的说法不正确的是

A.C1电极产生气泡原因:![]()
B.可以用两根铁钉代替铅笔芯完成实验
C.自制消毒剂的总反应为:NaCl+H2O ![]() NaClO+H2↑
NaClO+H2↑
D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,乳酸的摩尔质量为90g/moL;“A-”表示乳酸根离子)。则下列说法不正确的是

A.交换膜 I为只允许阳离子透过的阳离子交换膜
B.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C.电解过程中采取一定的措施可控制阴极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。设200mL 20g/L乳酸溶液通电一段时间后阴极上产生的H2在标准状况下的体积约为6.72L,则该溶液浓度上升为155g/L(溶液体积变化忽略不计)
D.浓缩室内溶液经过电解后pH降低
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com