
【题目】某铜钴矿石主要含有CoOOH、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
I.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡,过滤,分离除去沉淀a。
II.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀b[主要成分是Na2Fe6(SO4)4(OH)12]。
III.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀c。
IV.III中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃ 煅烧,即得到Co2O3。
请回答:
(1)I 中,沉淀a的成分是_____,稀硫酸溶解CoCO3的化学方程式是_____, 加入Na2SO3溶液的主要作用是_________。
(2)根据图1、图2

①矿石粉末浸泡的适宜条件应是:温度_____、pH_____。
②图2中铜、钴浸出率下降的可能原因是_____。
(3)II中,浸出液中的金属离子与NaClO3反应的离子方程式:ClO![]() +_____+_____== Cl- +_____+ _____
+_____+_____== Cl- +_____+ _____
(4)I中,检验铁元素完全除去的试剂是_____,实验现象是_____。
(5)I中,沉淀c的成分是CaF2、_____(填化学式)。
(6)V中,加入Na2CO3的作用是_____。
(7)V中,分离出纯净的CoC2O4·2H2O的操作是_____。
【答案】SiO2 CoCO3+H2SO4═CoSO4+CO2↑+H2O 将Co3+和Fe3+分别还原为Co2+及Fe2+(或作还原剂) 65℃-75℃ 0.5-1.5 pH升高后溶液中c(H+)浓度下降,使得溶解CoO(OH)、CoCO3、Cu2(OH)2CO3的能力下降 6Fe2+ 6H+ 6Fe3+ 3H2O KSCN溶液 溶液不变红色 MgF2 调节溶液的pH富集Co2+(生成CoCO3沉淀) 过滤、洗涤
【解析】
(1)铜钴矿石主要含有CoOOH、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等杂质中只有SiO2不与硫酸反应,得出沉淀a的成分;CoCO3和H2SO4反应生成CoSO4、CO2和H2O,据此书写化学方程式;Na2SO3中的S元素为+4价,具有较强还原性,加Na2SO3将CoO(OH)、Fe2O3中的Co3+和Fe3+还原为Co2+及Fe2+;
(2)①根据图1、图2分析钴、铜的浸出率最高的温度和pH;
②图2中pH逐渐增大时,H+的含量减少,故因反应量减少而浸出率降低;
(3)由Ⅳ可知,Co为+2价,价态并未升高,被氧化的是Fe2+;结合化合价升降相等配平该反应的离子方程式;
(4)检验铁是否除尽,只需检验滤液中是否有Fe3+即可;铁元素完全除去,加入KSCN溶液不变红;
(5)由题可知,杂质离子除之外Ca2+,还有Mg2+,据此判断另一沉淀;
(6)由Ⅱ知加入Na2CO3 溶液,通过![]() 水解提供OH-;由Ⅳ知加入Na2CO3溶液,提供
水解提供OH-;由Ⅳ知加入Na2CO3溶液,提供![]() ;
;
(7)通过过滤、洗涤操作从溶液分离出纯净的沉淀。
(1)铜钴矿石主要含有CoOOH、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等杂质中只有SiO2不与硫酸反应,得出沉淀a的成分为SiO2,碳酸盐与稀硫酸的反应,稀硫酸溶解CoCO3的化学方程式是:CoCO3+H2SO4= CoSO4+CO2↑+H2O;
因为Na2SO3中的S元素为+4价,且Ⅱ中加入NaClO3氧化出Fe3+,加Na2SO3将CoO(OH)、Fe2O3中的Co3+和Fe3+还原为Co2+及Fe2+,Na2SO3作还原剂。故答案为:SiO2;CoCO3+H2SO4= CoSO4+CO2↑+H2O;将Co3+和Fe3+分别还原为Co2+及Fe2+(或作还原剂);
(2)①根据图1、图2分析,温度在65℃-75℃时,钴、铜的浸出率最高,且之后铜的浸出率变化不大,钴的浸出率有下降趋势。在图2中pH:0.5-1.5铜、钴的浸出率最高,pH>1.5,铜、钴的浸出率开始下降,故答案为:65℃-75℃;pH:0.5-1.5;
②图2是pH变化对铜、钴浸出率的影响,浸出过程中是利用H+和CoO(OH)、CoCO3、
Cu2(OH)2CO3中的OH-和![]() 反应,使得Co3+和Co2+溶解在溶液中,当pH逐渐增大时,H+的含量减少,故因反应量减少而浸出率降低,故答案为:pH升高后溶液中c(H+)浓度下降,使得溶解CoO(OH)、CoCO3、Cu
反应,使得Co3+和Co2+溶解在溶液中,当pH逐渐增大时,H+的含量减少,故因反应量减少而浸出率降低,故答案为:pH升高后溶液中c(H+)浓度下降,使得溶解CoO(OH)、CoCO3、Cu
(3)由Ⅳ可知,Co为+2价,价态并未升高,被氧化的是Fe2+,由化合价升降相等配平离子方程式为:![]() ,故答案为:6Fe2+;6H+;6Fe3+;3H2O;
,故答案为:6Fe2+;6H+;6Fe3+;3H2O;
(4)检验铁是否除尽,只需检验滤液中是否有Fe3+,所以加入KSCN溶液,溶液是否变红即可,故答案为:KSCN溶液;溶液不变红色;
(5)由题可知,杂质离子除Ca2+之外,还有Mg2+,故另一沉淀为MgF2,故答案为:MgF2;
(6)由Ⅱ知,Fe3+形成沉淀b需要OH-,故加入Na2CO3 溶液,通过![]() 水解提供OH-;由Ⅳ知,要形成CoCO3 沉淀,需要加入Na2CO3 溶液,提供
水解提供OH-;由Ⅳ知,要形成CoCO3 沉淀,需要加入Na2CO3 溶液,提供![]() ,故答案为:调节溶液的pH;富集Co2+(生成CoCO3沉淀);
,故答案为:调节溶液的pH;富集Co2+(生成CoCO3沉淀);
(7)将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生CoC2O42H2O沉淀,由溶液分离出纯净的沉淀,操作应为过滤、洗涤,故答案为:过滤、洗涤。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓缓通过无水CaCl2时,CaCl2的质量增加22.5 g。原混合气体中CO2的质量为( )
A.13.2 gB.26.4 gC.19.7 gD.24.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有下列各组物质:(A)O2和O3;(B)23592U和23892U;(C) CH3CH2CH2CH3和 ;(D)
;(D) 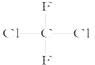 和
和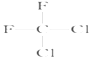 ;(E)甲烷和新戊烷。
;(E)甲烷和新戊烷。
(1)__________组两物质互为同位素;
(2)__________组两物质互为同素异形体;
(3)__________组两物质互为同系物;
(4)__________组两物质互为同分异构体。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法淡化海水装置示意图如下,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是( )
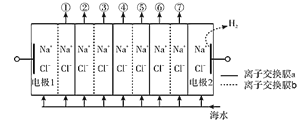
A.离子交换膜a为阴离子交换膜
B.通电时,电极2附近溶液的pH增大
C.淡化过程中,得到的浓缩海水没有任何使用价值
D.各间隔室的排出液中,②④⑥为淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子组在指定的溶液中能够大量共存的是
A.无色溶液中:Cu2+、K+、SCN、Cl
B.pH=11的NaOH 溶液中:CO![]() 、Na+、NO
、Na+、NO![]() 、SO
、SO![]()
C.由水电离出的 c(H+)=1.0×1013 mol·L1 的溶液中:Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
D.含有NO![]() 的溶液中:I- 、SO
的溶液中:I- 、SO![]() 、SO
、SO![]() 、H+
、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A. 该反应的ΔH>0
B. NH3的体积分数不变时,该反应一定达到平衡状态
C. A点对应状态的平衡常数K(A)=10-2.294
D. 30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应![]() 的
的![]() ,
,![]() 、
、![]() 分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为_____kJ。
分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为_____kJ。
(2)对于一般的化学反应aA+bB→P,反应物浓度和反应速率之间存在以下关系: v(单位mol·L-1·min-1)=k×c(A)x ×c(B)y,k称为速率常数,x称为反应物A的级数,y称为反应物B的级数,x+y称为反应的总级数。
① 对于反应H2(g)+I2(g)→2HI(g),速率表达式:v=k×c(H2)×c(I2),则反应总级数为________级。
② H2O2分解成水和氧气的反应是一级反应,反应速率常数k为0.0410 min-1,则过氧化氢分解一半的时间是__________min。(结果保留3位有效数字)(已知:一级反应物质浓度c=c0e-kt,c0为初始浓度,ln2=0.693)
(3)将等物质的量的I2和H2置于预先抽真空的特制1L密闭容器中,加热到1500 K,起始总压强为416kPa;体系达平衡,总压强为456kPa。体系中存在如下反应关系:
①I2(g)2I(g) Kp1 = 200 ΔH1
②I2(g)+ H2(g)2HI(g) Kp2 ΔH2
③HI(g)I(g)+ H(g) Kp3 ΔH3
④H2(g)2H(g) Kp4 ΔH4
(已知Kp3、 Kp4值很小,③、④反应忽略;Kp为以分压表示的平衡常数,以下计算结果均保留2位有效数字)
①ΔH2=_____________。(用含ΔH1、ΔH3、ΔH4的式子表示)
②1500K平衡体系中I(g)、H2(g)分压分别为______kPa、_______kPa、Kp2=______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com