
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓缓通过无水CaCl2时,CaCl2的质量增加22.5 g。原混合气体中CO2的质量为( )
A.13.2 gB.26.4 gC.19.7 gD.24.4 g
【答案】A
【解析】
CH4燃烧产物为CO、CO2、H2O(g),产物通过无水CaCl2时,无水CaCl2的作用是吸收水分,无水CaCl2增重25.2g为水的质量,根据H原子守恒可计算CH4的物质的量,根据C原子守恒可计算CO和CO2的总的物质的量,再根据二者质量可计算CO2的物质的量,进而计算CO2质量。
产物通过无水CaCl2时,无水CaCl2增重25.2g为水的质量,所以n(H2O)=![]() =1.4mol,根据H原子守恒,可知:n(CH4)=
=1.4mol,根据H原子守恒,可知:n(CH4)=![]() n(H2O)=
n(H2O)=![]() ×1.4mol=0.7mol,根据C原子守恒,则:n(CO)+n(CO2)=0.7mol,且m(CO)+m(CO2)=49.6g-25.2g=24.4g,所以[0.7mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=24.4g,解之:n(CO2)=0.3mol,所以生成二氧化碳的质量为0.3mol×44g/mol=13.2g,故答案为A。
×1.4mol=0.7mol,根据C原子守恒,则:n(CO)+n(CO2)=0.7mol,且m(CO)+m(CO2)=49.6g-25.2g=24.4g,所以[0.7mol-n(CO2)]×28g/mol+n(CO2)×44g/mol=24.4g,解之:n(CO2)=0.3mol,所以生成二氧化碳的质量为0.3mol×44g/mol=13.2g,故答案为A。


科目:高中化学 来源: 题型:
【题目】有关电化学示意图如下。回答下列问题:
(1)图中正极的电极反应是______;当Zn片的质量减少0.65g时,外电路中有_____mol电子通过。

(2)预测图中U型管的实验现象是______;结合化学用语解释产生现象的原因____。

(3)用石墨电极电解滴加紫色石蕊溶液的稀Na2SO4溶液,通电后A、B两极均有无色气体生成,装置如图所示:
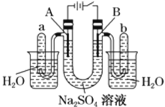
①NaOH在______极生成(填“A”或“B”)。
②B极发生反应的类型为______反应(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
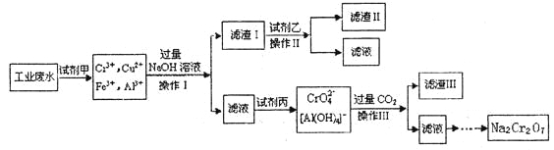
【题目】电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用铬元素,此工业废水通常采用如下流程处理:
已知:
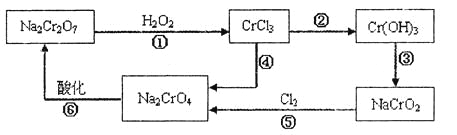
(1) 铬元素有以下循环过程:
(2) Cu(OH)2能溶于氨水:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答下列问题:
(1)加入试剂甲的目的:__________;
(2)试剂乙的名称:___________,试剂丙的化学式:_________;
(3) 上述操作I、Ⅱ、Ⅲ相同,则进行该实验操作所需要的主要玻璃仪器有________;
(4)滤渣I的主要成分为__________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:__________;
(6) 铬元素循环过程的反应⑥的离子方程式______________;废水处理流程中生成滤渣Ⅲ的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)如图是1mol NO2(g)和 1mol CO(g)反应生成 1mol CO2(g)和 1mol NO(g)过程中能量变化示意图。

①该反应是_________(填“吸热”或 “放热”)反应。
②请写出反应的热化学方程式_________。
③若在该反应体系中加入催化剂对反应热_________(填“有”或“没有”)影 响。原因是_________。
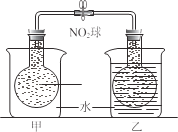
(2)已知,可逆反应2NO2 (g)N2O4 (g) ΔH=56.9 kJ/mol。在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色变深。根据现象,补全CaO与H2O反应过程的能量变化示意图_________。
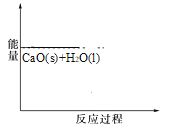
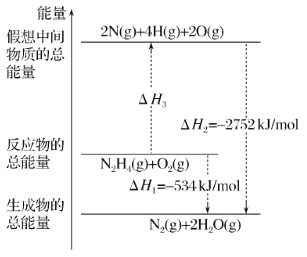
(3)肼(N2H4)是一种应用广泛的化工原料,可作为火箭发动机的燃料。已知断裂 1 mol 化学键所需的能量:N≡N 为 942 kJ、O=O 为 500 kJ、N-N 为154 kJ,则断裂 1 mol N-H 键所需的能量是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| 700 | 800 | 830 |
|
|
K |
|
|
|
|
|
下列有关叙述不正确的是![]()
![]()
A.该反应的化学方程式是![]()
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入![]() 和
和![]() 各
各![]() ,
,![]() 内温度升高到
内温度升高到![]() ,测得此时
,测得此时![]() 为
为![]() 时,推知此时反应为平衡状态
时,推知此时反应为平衡状态
D.如果平衡浓度符合关系式![]() ,判断此时的温度是
,判断此时的温度是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知反应![]() ,在某温度下的平衡常数为400。此温度下,在密闭容器中加入
,在某温度下的平衡常数为400。此温度下,在密闭容器中加入![]() ,反应进行到某时刻测得各组分的浓度如下:
,反应进行到某时刻测得各组分的浓度如下:
物质 |
|
|
|
浓度 |
|
|
|
下列叙述中正确的是![]()
A.该反应的平衡常数表达式为 ![]()
B.该时刻正、逆反应速率的大小:![]()
C.平衡时![]()
D.若加入![]() 后,经
后,经![]() 反应达到平衡,该时间内反应速率
反应达到平衡,该时间内反应速率![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某铜钴矿石主要含有CoOOH、CoCO3、Cu2(OH)2CO3和SiO2,其中还含有一定量的Fe2O3、MgO和CaO等。由该矿石制备Co2O3的部分工艺过程如下:
I.将粉碎的矿石用过量的稀H2SO4和Na2SO3溶液浸泡,过滤,分离除去沉淀a。
II.浸出液除去含铜的化合物后,向溶液中先加入NaClO3溶液,再加入一定浓度的Na2CO3溶液,过滤,分离除去沉淀b[主要成分是Na2Fe6(SO4)4(OH)12]。
III.向上述滤液中加入足量NaF溶液,过滤,分离除去沉淀c。
IV.III中滤液加入浓Na2CO3溶液,获得CoCO3沉淀。
V.将CoCO3溶解在盐酸中,再加入(NH4)2C2O4溶液,产生 CoC2O4·2H2O沉淀。分离出沉淀,将其在400℃~600℃ 煅烧,即得到Co2O3。
请回答:
(1)I 中,沉淀a的成分是_____,稀硫酸溶解CoCO3的化学方程式是_____, 加入Na2SO3溶液的主要作用是_________。
(2)根据图1、图2

①矿石粉末浸泡的适宜条件应是:温度_____、pH_____。
②图2中铜、钴浸出率下降的可能原因是_____。
(3)II中,浸出液中的金属离子与NaClO3反应的离子方程式:ClO![]() +_____+_____== Cl- +_____+ _____
+_____+_____== Cl- +_____+ _____
(4)I中,检验铁元素完全除去的试剂是_____,实验现象是_____。
(5)I中,沉淀c的成分是CaF2、_____(填化学式)。
(6)V中,加入Na2CO3的作用是_____。
(7)V中,分离出纯净的CoC2O4·2H2O的操作是_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据央广新闻报道,2016年我国河南桐柏县发现特大金矿,含金量近105吨可挖80年。除了发现的特大金矿,同时还发现大量天然碱、铅锌矿产资源。根据上述信息,回答下列问题:
(1)铅原子的价层电子排布式为__________,原子核外有__________个未成对电子。
(2)锌与镓(Ga)同周期,锌的第一电离能大于镓的第一电离能,其原因是________________。
(3)天然碱的化学式为Na2CO3·NaHCO3·2H2O。
(I)天然碱的晶体类型是__________;H2O的VSEPR模型为______________。
(Ⅱ)Na2CO3中存在的作用力类型主要有__________,CO32-中C的杂化类型为___________。
(4)金是贵重金属。冶金工业上,提取金的原理是2[Au(CN)2]一+Zn=2Au+[Zn(CN)4]2-。与CN一互为等电子体的离子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
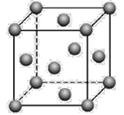
(5)金晶体的晶胞结构如图所示。已知金的密度为ρ g·cm3,摩尔质量M(Au)=197g·mol-1,阿伏加德罗常数为NA。则晶体中金原子的配位数为_______,金原子(或粒子)的半径r=___pm(用含ρ和NA的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷的浓硫酸。但某兴趣小组的同学发现将一定量的生铁与浓硫酸加热时,观察到固体能完全溶解,并产生大量气体。为此他们进行了如下探究实验。
[探究一]称取铁钉(碳素钢)6.0g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X,并收集到气体Y。
(1)(I)甲同学认为X中除Fe3+外还可能含有Fe2+。若要判断溶液X中是否含有Fe2+,可以选用___________。
a.KSCN溶液和氯水 b.K3[Fe(CN)6]溶液 c.浓氨水 d.酸性KMnO4溶液
(Ⅱ)乙同学将336 mL(标准状况)气体Y通入足量溴水中,发现溶液颜色变浅,试用化学方程式解释溴水颜色变浅的原因___________,然后向反应后的溶液中加入足量BaCl2溶液,经适当操作得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为___________。(结果保留一位小数)。
[探究二]甲乙两同学认为气体Y中除SO2外,还可能含有H2和CO2。为此设计如图实验装置(图中夹持仪器省略)进行验证。

(2)简述该实验能产生少量H2的原因___________(用化学用语结合少量文字表述)。
(3)装置B中试剂的作用是___________,装置F的作用是___________。
(4)为了进一步确认CO2的存在,需在上述装置中添加M于___________(选填序号),M中所盛装的试剂可以是___________。
a.A~B之间 b.B~C之间 c.C~D之间 d.E~F之间
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com