
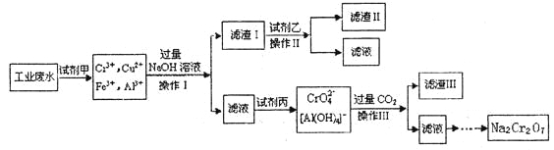
【题目】电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用铬元素,此工业废水通常采用如下流程处理:
已知:
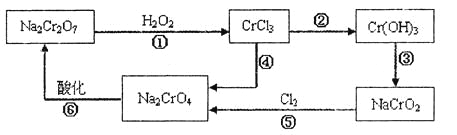
(1) 铬元素有以下循环过程:
(2) Cu(OH)2能溶于氨水:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答下列问题:
(1)加入试剂甲的目的:__________;
(2)试剂乙的名称:___________,试剂丙的化学式:_________;
(3) 上述操作I、Ⅱ、Ⅲ相同,则进行该实验操作所需要的主要玻璃仪器有________;
(4)滤渣I的主要成分为__________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:__________;
(6) 铬元素循环过程的反应⑥的离子方程式______________;废水处理流程中生成滤渣Ⅲ的离子方程式________。
【答案】将Fe2+氧化成Fe3+ 氨水 Cl2 烧杯、漏斗、玻璃棒 Cu(OH)2、Fe(OH)3 ![]() ×6.02×1023 2CrO42-+2H+Cr2O72-+H2O 2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-
×6.02×1023 2CrO42-+2H+Cr2O72-+H2O 2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-
【解析】
(1)根据废水的成分和加入试剂甲以后废水的成分来回答;
(2)试剂乙可以将氢氧化铜沉淀溶解掉;试剂丙可以将CrO2-转化为CrO42-;
(3)根据实验的目的判断实验操作,据此分析判断所需要的主要玻璃仪器;
(4)根据氢氧化钠和各个离子之间的反应以及反应的产物来回答;
(5)根据重铬酸根和双氧水在酸性环境下的反应来回答;
(6)反应⑥为铬酸根在酸性条件下可以转化为重铬酸根;向四羟基合铝酸根中通入过量二氧化碳会生成滤渣Ⅲ。
(1)在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,加入试剂甲以后废水的成分含有Cr3+、Cu2+、Fe3+和Al3+,由此可见试剂甲将亚铁离子氧化为三价铁离子,故答案为将Fe2+氧化成Fe3+;
(2)向含有Cr3+、Cu2+、Fe3+和Al3+的溶液中加入过量的氢氧化钠,生成的沉淀即滤渣Ⅰ有氢氧化铜和氢氧化铁,根据题意信息Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O,所以试剂乙可以将氢氧化铜沉淀溶解掉,应为氨水,根据铬元素的循环过程,可知试剂丙可以将CrO2-氧化为CrO42-,实现三价铬到CrO42-的转化,所以试剂丙是氯气,故答案为氨水;Cl2;
(3)操作I、Ⅱ、Ⅲ均实现了难溶固体和液体的分离,是过滤,过滤实验操作所需要的主要玻璃仪器有烧杯、漏斗、玻璃棒,故答案为烧杯、漏斗、玻璃棒;
(4)向含有Cr3+、Cu2+、Fe3+和Al3+的溶液中加入过量的氢氧化钠,生成的沉淀即滤渣Ⅰ有氢氧化铜和氢氧化铁,故答案为Cu(OH)2、Fe(OH)3;
(5)重铬酸根和双氧水在酸性环境下的反应实质是:Cr2O72-+3H2O2+8H+=7H2O+3O2↑+2Cr3+,每反应掉1molH2O2同时消耗H+的物质的量为![]() mol,数目为:
mol,数目为:![]() ×6.02×1023,故答案为
×6.02×1023,故答案为![]() ×6.02×1023;
×6.02×1023;
(6)反应⑥为铬酸根在酸性条件下可以转化为重铬酸根,即2CrO42-+2H+Cr2O72-+H2O;向四羟基合铝酸根中通入过量二氧化碳会生成氢氧化铝和碳酸氢钠,反应的离子方程式为2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-,故答案为2CrO42-+2H+Cr2O72-+H2O;2H2O+A1O2-+CO2=Al(OH)3↓+HCO3-。


 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】常见的太阳能电池有单晶硅或多晶硅太阳能电池、GaAs太阳能电池及铜铟镓硒薄膜太阳能电池等。请回答下列问题:
(1)基态硒原子的价电子排布式为___;H2O的沸点高于H2Se的沸点(-42℃),其原因是___。
(2)已知GaCl3晶体熔点为77.9℃,沸点为201.3℃,GaCl3品体类型为____。
(3)Na3AsO4中阴离子的空间构型为_____,As原子采取_____杂化。
(4)高温下CuO容易转化为Cu2O,试从原子结构角度解释原因:_____。
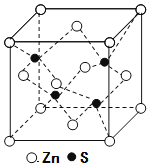
(5)锌与铜位于同一周期。硫化锌的晶胞结构如图所示,S2-周围等距离且最近的Zn2+个数为____;若晶胞边长为dpm,则硫化锌的密度为____g·cm-3(不必简化)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容密闭容器中,将10mol CO和一定量的H2S混合加热并达到下列平衡:CO(g)+H2S(g) ![]() COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
COS(g)+H2(g) K=1,平衡后CO物质的量为8mol。下列说法正确的是( )
A.CO、H2S的转化率之比为1∶1
B.达平衡后H2S的体积分数为4%
C.升高温度,COS浓度减小,表明该反应是吸热反应
D.恒温下向平衡体系中再加入CO、H2S、COS、H2各1mol,平衡不移动
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容不正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
原理 | 牺牲阳极的阴极保护法 | 电镀 | 电解CuCl2溶液 | 氢氧燃料电池 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.利用甲烷催化还原NOx消除氮氧化物的污染
①CH4(g)+4NO2(g) ![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
③CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g) ΔH3=-867 kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH3=-867 kJ·mol-1
(1)如果三个反应的平衡常数依次为K1、K2、K3,则K3=________(用K1、K2表示)。
(2)在2L恒容密闭容器中充入1 mol CH4和2 mol NO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
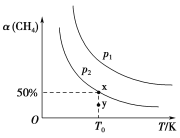
①若容器中的压强为p2,y点:v正________(填“大于”“等于”或“小于”)v逆。
②x点对应温度下反应的平衡常数K=________。
Ⅱ.甲烷蒸气转化法制H2的主要反应为:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
(3)在恒容密闭容器中充入2 mol CH4和H2O(g)的混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下达到平衡时测得H2的体积分数φ(H2)与x的关系如图所示。
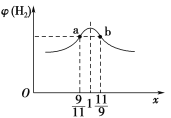
则CH4的转化率:a点________(填“>”“=”或“<”,下同)b点,CH4(g)的浓度:a点________b点,氢气的产率:a点________b点。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用反应6NO2+8NH3=7N2+12H2O构成电池的方法,既能实现有效消除氮氧化物的排放,减轻环境污染,又能充分利用化学能,装置如图所示。下列说法不正确的是( )
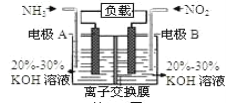
A.电流从右侧电极经过负载后流向左侧电极
B.A电极上发生氧化反应,B为正极
C.当有2.24LNO2(标准状况)被处理时,转移电子为0.4mol
D.电极A极反应式为2NH3-6e-=N2+6H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温、恒容的密闭容器中进行反应 A(g)═B(g)+C(g),若反应物的浓度由2molL-1 降到 0.8molL-1 需要 20s,那么反应物浓度再由 0.8molL-1 降到 0.2molL-1 所需要的时间为
A.10sB.大于 10sC.小于 10sD.无法判断
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓缓通过无水CaCl2时,CaCl2的质量增加22.5 g。原混合气体中CO2的质量为( )
A.13.2 gB.26.4 gC.19.7 gD.24.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A. 该反应的ΔH>0
B. NH3的体积分数不变时,该反应一定达到平衡状态
C. A点对应状态的平衡常数K(A)=10-2.294
D. 30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com