
【题目】Ⅰ.利用甲烷催化还原NOx消除氮氧化物的污染
①CH4(g)+4NO2(g) ![]() 4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
4NO(g)+CO2(g)+2H2O(g) ΔH1=-574 kJ·mol-1
②CH4(g)+4NO(g) ![]() 2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
2N2(g)+CO2(g)+2H2O(g) ΔH2=-1 160 kJ·mol-1
③CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g) ΔH3=-867 kJ·mol-1
N2(g)+CO2(g)+2H2O(g) ΔH3=-867 kJ·mol-1
(1)如果三个反应的平衡常数依次为K1、K2、K3,则K3=________(用K1、K2表示)。
(2)在2L恒容密闭容器中充入1 mol CH4和2 mol NO2进行反应③,CH4的平衡转化率α(CH4)与温度和压强的关系如图所示。
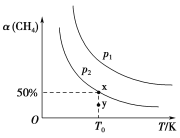
①若容器中的压强为p2,y点:v正________(填“大于”“等于”或“小于”)v逆。
②x点对应温度下反应的平衡常数K=________。
Ⅱ.甲烷蒸气转化法制H2的主要反应为:CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
(3)在恒容密闭容器中充入2 mol CH4和H2O(g)的混合气体,且CH4和H2O(g)的物质的量之比为x,相同温度下达到平衡时测得H2的体积分数φ(H2)与x的关系如图所示。
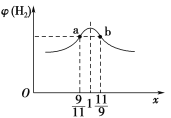
则CH4的转化率:a点________(填“>”“=”或“<”,下同)b点,CH4(g)的浓度:a点________b点,氢气的产率:a点________b点。
【答案】![]() 大于 0.25 > = =
大于 0.25 > = =
【解析】
Ⅰ.(1)分别写出K1、K2、K3的表达式,可以求出K3与K1、K2的关系;
(2)①y点在p2对应曲线下方,要达到平衡状态,需使甲烷的转化率增大,反应正向进行;
②结合题图1,根据三段式可以求出该温度下反应的平衡常数K;
Ⅱ.(3)x越大,加入的甲烷的量越多,因此甲烷的转化率越低;结合题给图像根据三段式进行分析判断;
Ⅰ.(1)K1=[c2(H2O)c(CO2)c4(NO)]/[c(CH4)c4(NO2)],K2=[c2(H2O)c(CO2)c2(N2)]/[c(CH4)c4(NO)],K3=[c2(H2O)c(CO2)c(N2)]/[c(CH4)c2(NO2)];所以K32= K1 K2,所以K3=![]() ;
;
答案是:![]() ;
;
(2)①y点在p2对应曲线下方,要达到平衡状态,需使甲烷的转化率增大,则y点:v正大于v逆;
答案是:大于;
②由题图1可知,x点甲烷的平衡转化率是50%,则有:
CH4(g)+2NO2(g) ![]() N2(g)+CO2(g)+2H2O(g)
N2(g)+CO2(g)+2H2O(g)
起始/(mol·L-1)0.5 1 0 0 0
转化/(mol·L-1)0.25 0.5 0.25 0.25 0.5
平衡/(mol·L-1)0.25 0.5 0.25 0.25 0.5
因此该温度下反应的平衡常数K=![]() =0.25;
=0.25;
答案是:0.25;
Ⅱ.(3)x越大,加入的甲烷的量越多,因此甲烷的转化率越低,故a点甲烷的转化率大于b点甲烷的转化率;当CH4和H2O(g)的物质的量之比的比值为9/11时,则起始时,甲烷的物质的量为0.9 mol,H2O(g)的物质的量为1.1 mol,反应达到平衡时,设CH4转化了n mol,则有:
CH4(g)+H2O(g)![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始/(mol) 0.9 1.1 0 0
转化/(mol) n n n 3n
平衡/(mol) 0.9-n 1.1-n n 3n
此时氢气的体积分数为3n/(2+2n),当CH4和H2O(g)的物质的量之比的比值为11/9时,起始时,甲烷的物质的量为1.1 mol,H2O(g)的物质的量为0.9 mol,反应达到平衡时,设CH4转化了y mol,则有:
CH4(g)+H2O(g) ![]() CO(g)+3H2(g)
CO(g)+3H2(g)
起始/(mol) 1.1 0.9 0 0
转化/(mol) y y y 3y
衡/(mol) 1.1-y 0.9-y y 3y
此时氢气的体积分数为3y/(2+2y),由题图2可知,a点和b点的氢气的体积分数相等,故n=y,a点甲烷的浓度等于b点水蒸气的浓度;两点的氢气产率相等;
故答案是:>; =;=。


 考前必练系列答案
考前必练系列答案科目:高中化学 来源: 题型:
【题目】我国具有丰富的铜矿资源,请回答下列有关铜及其化合物的问题:
(1)请写出基态Cu原子的价电子排布式_________。焰火中的绿色是铜的焰色,基态铜原子在灼烧时价电子发生了_________ 而变为激发态。
(2)黄铜是人类最早使用的合金之一,主要由Zn和Cu组成。第一电离能Il(Zn)______ Il(Cu)(填“大于”或“小于”),原因是___________。
(3)新型农药松脂酸铜具有低残留的特点,下图是松脂酸铜的结构简式:

请分析1个松脂酸铜中π键的个数___________加“*”碳原子的杂化方式为_____________。
(4)硫酸铜溶于氨水形成![]() 4深蓝色溶液。
4深蓝色溶液。
① ![]() 中阴离子的立体构型是_______。
中阴离子的立体构型是_______。
②在![]() 中
中![]() 之间形成的化学键称为_____,提供孤电子对的成键原子是_______________________。
之间形成的化学键称为_____,提供孤电子对的成键原子是_______________________。
③氨的沸点_________________(填“高于”或“低于”)膦;
(5)黄铜合金可以表示为![]() ,为面心立方晶胞,晶体密度为8.5
,为面心立方晶胞,晶体密度为8.5![]() ,求晶胞的边长___________(只写计算式,不求结果)
,求晶胞的边长___________(只写计算式,不求结果)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图曲线表示其他条件一定时,2NO(g)+O2(g)![]() 2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )
2NO2(g) △H<0反应中NO2的百分含量与温度的关系曲线,图中标有a、b、c、d四点,其中表示未达到平衡状态,且v(正)>v(逆)的点是( )

A. a点B. b点C. c点D. d点
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是![]()
A.硬脂酸与乙醇的酯化反应:![]()
![]()
![]()
B.常温时,![]() 氨水的
氨水的![]() :
:![]()
C.由Na和Cl形成离子键的过程:![]()
![]()
![]()
D.电解精炼铜的阴极反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
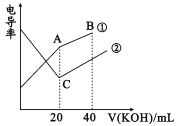
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用铬元素,此工业废水通常采用如下流程处理:
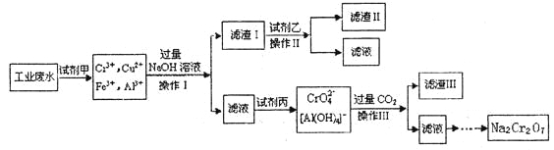
已知:
(1) 铬元素有以下循环过程:
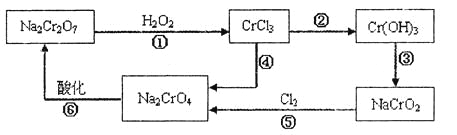
(2) Cu(OH)2能溶于氨水:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答下列问题:
(1)加入试剂甲的目的:__________;
(2)试剂乙的名称:___________,试剂丙的化学式:_________;
(3) 上述操作I、Ⅱ、Ⅲ相同,则进行该实验操作所需要的主要玻璃仪器有________;
(4)滤渣I的主要成分为__________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:__________;
(6) 铬元素循环过程的反应⑥的离子方程式______________;废水处理流程中生成滤渣Ⅲ的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| 700 | 800 | 830 |
|
|
K |
|
|
|
|
|
下列有关叙述不正确的是![]()
![]()
A.该反应的化学方程式是![]()
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入![]() 和
和![]() 各
各![]() ,
,![]() 内温度升高到
内温度升高到![]() ,测得此时
,测得此时![]() 为
为![]() 时,推知此时反应为平衡状态
时,推知此时反应为平衡状态
D.如果平衡浓度符合关系式![]() ,判断此时的温度是
,判断此时的温度是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1 和C2)、电源适配器和水瓶组装如图所示的装置。接通电源观察到:C1 周围产生细小气泡,C2 周围无明显现象;持续通电一段时间后,C2 周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。关于该实验的说法不正确的是

A.C1电极产生气泡原因:![]()
B.可以用两根铁钉代替铅笔芯完成实验
C.自制消毒剂的总反应为:NaCl+H2O ![]() NaClO+H2↑
NaClO+H2↑
D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com