
【题目】中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容不正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
原理 | 牺牲阳极的阴极保护法 | 电镀 | 电解CuCl2溶液 | 氢氧燃料电池 |
A.AB.BC.CD.D
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】下列实验方案中,不能达到相应实验目的的是
选项 | A | B | C | D |
实验方案 |
|
|
|
|
目的 | 研究温度对化学平衡的影响 | 验证锌与硫酸铜反应过程中有电子转移 | 证明溶解度:AgCl>Ag2S | 比较不同催化剂对化学反应速率的影响 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关电化学示意图如下。回答下列问题:
(1)图中正极的电极反应是______;当Zn片的质量减少0.65g时,外电路中有_____mol电子通过。

(2)预测图中U型管的实验现象是______;结合化学用语解释产生现象的原因____。

(3)用石墨电极电解滴加紫色石蕊溶液的稀Na2SO4溶液,通电后A、B两极均有无色气体生成,装置如图所示:
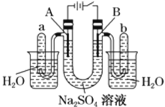
①NaOH在______极生成(填“A”或“B”)。
②B极发生反应的类型为______反应(填“氧化”或“还原”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】乙烯气相直接水合反应制备乙醇:C2H4(g)+H2O(g) ![]() C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
C2H5OH(g)。乙烯的平衡转化率随温度、压强的变化关系如下(起始时,n(H2O)=n(C2H4)=1 mol,容器体积为1 L)。下列分析不正确的是( )
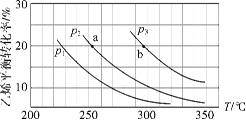
A.乙烯气相直接水合反应的H<0
B.图中压强的大小关系为:p1>p2>p3
C.图中a点对应的平衡常数K =![]()
D.达到平衡状态a、b所需要的时间:a>b
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列化学用语对事实的表述不正确的是![]()
A.硬脂酸与乙醇的酯化反应:![]()
![]()
![]()
B.常温时,![]() 氨水的
氨水的![]() :
:![]()
C.由Na和Cl形成离子键的过程:![]()
![]()
![]()
D.电解精炼铜的阴极反应:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)基态溴原子的价层电子轨道排布式为________。第四周期中,与溴原子未成对电子数相同的金属元素有_______种。
(2)铍与铝的元素性质相似。下列有关铍和铝的叙述正确的有___________(填标号)。
A.都属于p区主族元素B.电负性都比镁大
C.第一电离能都比镁大D.氯化物的水溶液pH均小于7
(3)Al元素可形成[AlF6]3-、[AlCl4]-配离子,而B元素只能形成[BF4]-配离子,由此可知决定配合物中配位数多少的因素是________________;[AlCl4]-的立体构型名称为______。
(4)P元素有白磷、红磷、黑磷三种常见的单质。
①白磷(P4)易溶于CS2,难溶于水,原因是________________
②黑磷是一种黑色有金属光泽的晶体,是一种比石墨烯更优秀的新型材料。白磷、红磷都是分子晶体,黑磷晶体与石墨类似的层状结构,如图所示。下列有关黑磷晶体的说法正确的是_________。

A.黑磷晶体中磷原子杂化方式为sp2杂化
B.黑磷晶体中层与层之间的作用力是分子间作用力
C.黑磷晶体的每一层中磷原子都在同一平面上
D.P元素三种常见的单质中,黑磷的熔沸点最高
(5)F2中F-F键的键能(157kJ/mol)小于Cl2中Cl-Cl键的键能(242.7kJ/mol),原因是_________。
(6)金属钾的晶胞结构如图。若该晶胞的密度为a g/cm3,阿伏加得罗常数为NA,则表示K原子半径的计算式为______。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电镀广泛地应用于工业生产中。在电镀铬的工业废水中主要含有Cr3+,同时还含有少量的Cu2+、Fe2+、Fe3+和Al3+等,且酸性较强。为回收利用铬元素,此工业废水通常采用如下流程处理:
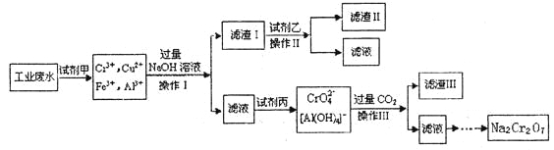
已知:
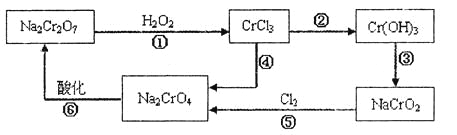
(1) 铬元素有以下循环过程:
(2) Cu(OH)2能溶于氨水:Cu(OH)2+4NH3H2O=[Cu(NH3)4]2++2OH-+4H2O
请回答下列问题:
(1)加入试剂甲的目的:__________;
(2)试剂乙的名称:___________,试剂丙的化学式:_________;
(3) 上述操作I、Ⅱ、Ⅲ相同,则进行该实验操作所需要的主要玻璃仪器有________;
(4)滤渣I的主要成分为__________(写化学式)。
(5)在铬元素循环过程的反应①中每反应掉1 mol H2O2同时消耗H+数目为:__________;
(6) 铬元素循环过程的反应⑥的离子方程式______________;废水处理流程中生成滤渣Ⅲ的离子方程式________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮是地球上含量丰富的一种元素,其单质及化合物在工农业生产、生活中有着重要作用。
(1)如图是1mol NO2(g)和 1mol CO(g)反应生成 1mol CO2(g)和 1mol NO(g)过程中能量变化示意图。

①该反应是_________(填“吸热”或 “放热”)反应。
②请写出反应的热化学方程式_________。
③若在该反应体系中加入催化剂对反应热_________(填“有”或“没有”)影 响。原因是_________。
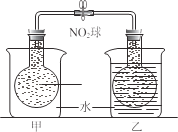
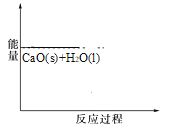
(2)已知,可逆反应2NO2 (g)N2O4 (g) ΔH=56.9 kJ/mol。在乙烧杯中投入一定量的CaO固体,此烧杯中NO2球的红棕色变深。根据现象,补全CaO与H2O反应过程的能量变化示意图_________。
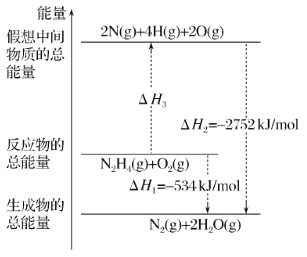
(3)肼(N2H4)是一种应用广泛的化工原料,可作为火箭发动机的燃料。已知断裂 1 mol 化学键所需的能量:N≡N 为 942 kJ、O=O 为 500 kJ、N-N 为154 kJ,则断裂 1 mol N-H 键所需的能量是_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据央广新闻报道,2016年我国河南桐柏县发现特大金矿,含金量近105吨可挖80年。除了发现的特大金矿,同时还发现大量天然碱、铅锌矿产资源。根据上述信息,回答下列问题:
(1)铅原子的价层电子排布式为__________,原子核外有__________个未成对电子。
(2)锌与镓(Ga)同周期,锌的第一电离能大于镓的第一电离能,其原因是________________。
(3)天然碱的化学式为Na2CO3·NaHCO3·2H2O。
(I)天然碱的晶体类型是__________;H2O的VSEPR模型为______________。
(Ⅱ)Na2CO3中存在的作用力类型主要有__________,CO32-中C的杂化类型为___________。
(4)金是贵重金属。冶金工业上,提取金的原理是2[Au(CN)2]一+Zn=2Au+[Zn(CN)4]2-。与CN一互为等电子体的离子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
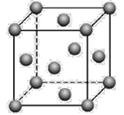
(5)金晶体的晶胞结构如图所示。已知金的密度为ρ g·cm3,摩尔质量M(Au)=197g·mol-1,阿伏加德罗常数为NA。则晶体中金原子的配位数为_______,金原子(或粒子)的半径r=___pm(用含ρ和NA的代数式表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com