
【题目】据央广新闻报道,2016年我国河南桐柏县发现特大金矿,含金量近105吨可挖80年。除了发现的特大金矿,同时还发现大量天然碱、铅锌矿产资源。根据上述信息,回答下列问题:
(1)铅原子的价层电子排布式为__________,原子核外有__________个未成对电子。
(2)锌与镓(Ga)同周期,锌的第一电离能大于镓的第一电离能,其原因是________________。
(3)天然碱的化学式为Na2CO3·NaHCO3·2H2O。
(I)天然碱的晶体类型是__________;H2O的VSEPR模型为______________。
(Ⅱ)Na2CO3中存在的作用力类型主要有__________,CO32-中C的杂化类型为___________。
(4)金是贵重金属。冶金工业上,提取金的原理是2[Au(CN)2]一+Zn=2Au+[Zn(CN)4]2-。与CN一互为等电子体的离子有________(任写一种),HCN分子中σ键和π键数目之比为_________。
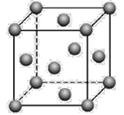
(5)金晶体的晶胞结构如图所示。已知金的密度为ρ g·cm3,摩尔质量M(Au)=197g·mol-1,阿伏加德罗常数为NA。则晶体中金原子的配位数为_______,金原子(或粒子)的半径r=___pm(用含ρ和NA的代数式表示)。
【答案】6s26p2 2 Zn的价电子排布式为3d104s2,全充满结构稳定,而Ga的价电子排布式为4s24p1,不稳定,所以锌的第一电离能大于镓的第一电离能 离子晶体 四面体形 离子键、共价键 sp2 ![]() 1:1 12
1:1 12 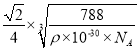
【解析】
(1)铅原子位于第六周期第ⅣA族,价电子排布为6s26p2;根据洪特规则,电子在能量相同的轨道上排布时,电子优先排布在不同的轨道上,且自旋方向相同,铅原子核外6p轨道上的2个电子未成对;
(2)Zn和Ga处于同一周期,锌原子价电子为3d104s2,镓位于周期表中第四周期第ⅢA,价电子排布式为4s24p1,Zn的4s能级处于全充满状态,较稳定,所以锌的第一电离能大于镓的第一电离能;
(3)(I)Na2CO3、NaHCO3属于离子化合物,所以Na2CO3·NaHCO3·2H2O是离子晶体;H2O中氧原子的价电子对数是![]() ,VSEPR模型为四面体;
,VSEPR模型为四面体;
(Ⅱ)Na2CO3是离子晶体,存在离子键、共价键,存在的作用力类型主要有离子键、共价键;CO32-中C原子的价电子对数是![]() ,C原子杂化方式是sp2;
,C原子杂化方式是sp2;
(4)CN一的原子数是2、价电子数是14,与CN一互为等电子体的离子有![]() ;单键为σ键,叁键中有1个σ键和2个π键,HCN的结构式是
;单键为σ键,叁键中有1个σ键和2个π键,HCN的结构式是![]() ,所以HCN分子中σ键和π键数目之比为1:1;
,所以HCN分子中σ键和π键数目之比为1:1;
(5)根据图示,金为面心立方晶胞,金原子配位数是离金原子最近且距离相等的原子数,金原子的配位数是12;根据均摊原则,1个晶胞中金原子数是![]() ,设晶胞的边长是a pm,晶胞的体积是
,设晶胞的边长是a pm,晶胞的体积是![]() ,则
,则![]() ρ,a=
ρ,a=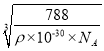 ;金原子半径等于面对角线的
;金原子半径等于面对角线的![]() ,金原子(或粒子)的半径r=
,金原子(或粒子)的半径r=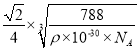 pm。
pm。


科目:高中化学 来源: 题型:
【题目】中学化学教材中,常借助于图像这一表现手段清晰地突出实验装置的要点、形象地阐述化学过程的原理。下列有关化学图像表现的内容不正确的是
选项 | A | B | C | D |
装置 |
|
|
|
|
原理 | 牺牲阳极的阴极保护法 | 电镀 | 电解CuCl2溶液 | 氢氧燃料电池 |
A.AB.BC.CD.D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓缓通过无水CaCl2时,CaCl2的质量增加22.5 g。原混合气体中CO2的质量为( )
A.13.2 gB.26.4 gC.19.7 gD.24.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法淡化海水装置示意图如下,电解槽中阴离子交换膜和阳离子交换膜相间排列,将电解槽分隔成多个独立的间隔室,海水充满在各个间隔室中。通电后,一个间隔室的海水被淡化,而其相邻间隔室的海水被浓缩,从而实现了淡水和浓缩海水分离。下列说法正确的是( )
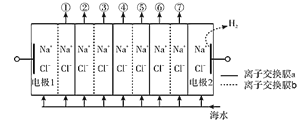
A.离子交换膜a为阴离子交换膜
B.通电时,电极2附近溶液的pH增大
C.淡化过程中,得到的浓缩海水没有任何使用价值
D.各间隔室的排出液中,②④⑥为淡水
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各离子组在指定的溶液中能够大量共存的是
A.无色溶液中:Cu2+、K+、SCN、Cl
B.pH=11的NaOH 溶液中:CO![]() 、Na+、NO
、Na+、NO![]() 、SO
、SO![]()
C.由水电离出的 c(H+)=1.0×1013 mol·L1 的溶液中:Na+、NH![]() 、SO
、SO![]() 、HCO
、HCO![]()
D.含有NO![]() 的溶液中:I- 、SO
的溶液中:I- 、SO![]() 、SO
、SO![]() 、H+
、H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W均为短周期元素,它们在元素周期表中的相对位置如图所示。若Z原子的最外层电子数是第一层电子数的3倍,下列说法中正确的是( )
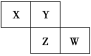
A. X的最常见气态氢化物的水溶液显酸性
B. 最高价氧化物对应水化物的酸性W比Z强
C. Z的单质与氢气反应比Y单质与氢气反应容易
D. X的原子半径小于Y
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A. 该反应的ΔH>0
B. NH3的体积分数不变时,该反应一定达到平衡状态
C. A点对应状态的平衡常数K(A)=10-2.294
D. 30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行反应![]() ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在![]() min内,各物质物质的量的变化如下表所示:
min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知2min内![]() ,
,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时![]() __________,
__________,![]() __________。
__________。
(2)方程式中m=__________,n=__________,p=__________,q=__________。
(3)用Z表示2min内的反应速率:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法不正确的是( )

A. Ksp[Cu(OH)2]的数量级为10-20
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
C. 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
D. 向Z点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com