
【题目】工业上常用铁质容器盛装冷的浓硫酸。但某兴趣小组的同学发现将一定量的生铁与浓硫酸加热时,观察到固体能完全溶解,并产生大量气体。为此他们进行了如下探究实验。
[探究一]称取铁钉(碳素钢)6.0g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X,并收集到气体Y。
(1)(I)甲同学认为X中除Fe3+外还可能含有Fe2+。若要判断溶液X中是否含有Fe2+,可以选用___________。
a.KSCN溶液和氯水 b.K3[Fe(CN)6]溶液 c.浓氨水 d.酸性KMnO4溶液
(Ⅱ)乙同学将336 mL(标准状况)气体Y通入足量溴水中,发现溶液颜色变浅,试用化学方程式解释溴水颜色变浅的原因___________,然后向反应后的溶液中加入足量BaCl2溶液,经适当操作得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为___________。(结果保留一位小数)。
[探究二]甲乙两同学认为气体Y中除SO2外,还可能含有H2和CO2。为此设计如图实验装置(图中夹持仪器省略)进行验证。

(2)简述该实验能产生少量H2的原因___________(用化学用语结合少量文字表述)。
(3)装置B中试剂的作用是___________,装置F的作用是___________。
(4)为了进一步确认CO2的存在,需在上述装置中添加M于___________(选填序号),M中所盛装的试剂可以是___________。
a.A~B之间 b.B~C之间 c.C~D之间 d.E~F之间
【答案】bd ![]() 66.7% 随反应进行,浓硫酸变为稀硫酸,铁与稀硫酸反应生成硫酸亚铁和氢气,
66.7% 随反应进行,浓硫酸变为稀硫酸,铁与稀硫酸反应生成硫酸亚铁和氢气,![]() 检验SO2是否除尽 防止空气中的水进入E,影响氢气的检验 b 澄清石灰水
检验SO2是否除尽 防止空气中的水进入E,影响氢气的检验 b 澄清石灰水
【解析】
(1)(I)Fe2+与K3[Fe(CN)6]溶液反应生成蓝色沉淀;Fe2+具有还原性,能使高锰酸钾溶液褪色;
(Ⅱ)铁与浓硫酸加热时,浓硫酸被还原为二氧化硫;
(2)铁和稀硫酸反应生成硫酸亚铁和氢气;
(3)高锰酸钾溶液能氧化吸收二氧化硫,品红检验二氧化硫;
(4)用澄清石灰水检验CO2。
(1)Fe2+能与K3[Fe(CN)6]溶液反应生成蓝色沉淀,Fe2+具有还原性,能使高锰酸钾溶液褪色;要判断溶液X中是否含有Fe2+,可以选用K3[Fe(CN)6]溶液或酸性KMnO4溶液,选bd;
(Ⅱ)铁与浓硫酸加热时,浓硫酸被还原为二氧化硫,二氧化硫具有还原性,二氧化硫通入足量溴水中,发生反应![]() ,所以溶液颜色变浅,反应后的溶液中加入足量BaCl2溶液,生成硫酸钡沉淀2.33 g,硫酸钡的物质的量是
,所以溶液颜色变浅,反应后的溶液中加入足量BaCl2溶液,生成硫酸钡沉淀2.33 g,硫酸钡的物质的量是![]() ,根据关系式
,根据关系式![]() ,可知二氧化硫的物质的量是0.01mol,由此推知气体Y中SO2的体积分数为
,可知二氧化硫的物质的量是0.01mol,由此推知气体Y中SO2的体积分数为![]() 66.7%。
66.7%。
(2)由于随反应进行,浓硫酸变为稀硫酸,铁和稀硫酸反应生成硫酸亚铁和氢气,反应的方程式为![]() ;
;
(3)高锰酸钾溶液能氧化吸收二氧化硫,品红检验二氧化硫,所以装置B中试剂的作用是检验SO2是否除尽;装置E用于检验装置D中是否有水生成,所以装置F的作用是防止空气中的水进入E,影响氢气的检验;
(4)C中的碱石灰能吸收二氧化碳,所以要确认CO2的存在,在B、C之间添加M,M中盛放澄清石灰水即可。


科目:高中化学 来源: 题型:
【题目】一定质量的甲烷燃烧后得到的产物为CO、CO2和水蒸气,此混合气体质量为49.6 g,当其缓缓通过无水CaCl2时,CaCl2的质量增加22.5 g。原混合气体中CO2的质量为( )
A.13.2 gB.26.4 gC.19.7 gD.24.4 g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将一定量氨基甲酸铵(NH2COONH4)加入密闭容器中,发生反应NH2COONH4(s)![]() 2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是
2NH3(g)+CO2(g)。该反应的平衡常数的负对数(-lgK)值随温度(T)的变化曲线如图所示,下列说法不正确的是

A. 该反应的ΔH>0
B. NH3的体积分数不变时,该反应一定达到平衡状态
C. A点对应状态的平衡常数K(A)=10-2.294
D. 30℃时,B点对应状态的v(正)<v(逆)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在2L密闭容器中进行反应![]() ,式中m、n、p、q为化学计量数。在
,式中m、n、p、q为化学计量数。在![]() min内,各物质物质的量的变化如下表所示:
min内,各物质物质的量的变化如下表所示:
物质 时间 | X | Y | Z | Q |
起始/mol | 0.7 | 1 | ||
2min末/mol | 0.8 | 2.7 | 0.8 | 2.7 |
3min末/mol | 0.8 |
已知2min内![]() ,
,![]() ,试确定以下物质的相关量:
,试确定以下物质的相关量:
(1)起始时![]() __________,
__________,![]() __________。
__________。
(2)方程式中m=__________,n=__________,p=__________,q=__________。
(3)用Z表示2min内的反应速率:____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为________mol。生成1 mol Cu3P时,参加反应的P的物质的量为________mol。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,向密闭恒容容器中加入1.0 mol·L-1X,发生反应:2X(g)![]() Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
Y(g) + Z(g) ΔH<0。反应到8min时达 到平衡;在14min时改变温度,16min时建立新平衡。X的物质的量浓度变化如图所示。下列有关说法正确的是( )
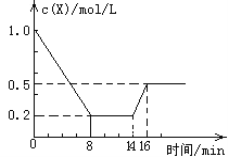
A. 0~8min用Y表示的该反应的速率为0.1mol·L-1·min-1
B. 8min时达到平衡,该反应的平衡常数为K=0.5
C. 14min时,改变的反应条件是降低了体系的温度
D. 16min时的正反应速率,比8min时的正反应速率大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)已知反应![]() 的
的![]() ,
,![]() 、
、![]() 分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为_____kJ。
分子中化学键断裂时分别需要吸收436 kJ、151 kJ的能量,则1 mol HI(g)分子中化学键断裂时需吸收的能量为_____kJ。
(2)对于一般的化学反应aA+bB→P,反应物浓度和反应速率之间存在以下关系: v(单位mol·L-1·min-1)=k×c(A)x ×c(B)y,k称为速率常数,x称为反应物A的级数,y称为反应物B的级数,x+y称为反应的总级数。
① 对于反应H2(g)+I2(g)→2HI(g),速率表达式:v=k×c(H2)×c(I2),则反应总级数为________级。
② H2O2分解成水和氧气的反应是一级反应,反应速率常数k为0.0410 min-1,则过氧化氢分解一半的时间是__________min。(结果保留3位有效数字)(已知:一级反应物质浓度c=c0e-kt,c0为初始浓度,ln2=0.693)
(3)将等物质的量的I2和H2置于预先抽真空的特制1L密闭容器中,加热到1500 K,起始总压强为416kPa;体系达平衡,总压强为456kPa。体系中存在如下反应关系:
①I2(g)2I(g) Kp1 = 200 ΔH1
②I2(g)+ H2(g)2HI(g) Kp2 ΔH2
③HI(g)I(g)+ H(g) Kp3 ΔH3
④H2(g)2H(g) Kp4 ΔH4
(已知Kp3、 Kp4值很小,③、④反应忽略;Kp为以分压表示的平衡常数,以下计算结果均保留2位有效数字)
①ΔH2=_____________。(用含ΔH1、ΔH3、ΔH4的式子表示)
②1500K平衡体系中I(g)、H2(g)分压分别为______kPa、_______kPa、Kp2=______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,Fe(OH)2和Cu(OH)2的饱和溶液中,金属阳离子的物质的量浓度的负对数[-lgc(M2+)]与溶液pH的变化关系如图所示,已知该温度下Ksp[Cu(OH)2]<Ksp[Fe(OH)2]。下列说法不正确的是( )

A. Ksp[Cu(OH)2]的数量级为10-20
B. 当Fe(OH)2和Cu(OH)2沉淀共存时,溶液中c(Fe2+)∶c(Cu2+)=104.6∶1
C. 除去CuSO4溶液中含有的少量Fe2+,可加入适量CuO
D. 向Z点对应的饱和溶液中加入少量NaOH固体,可转化为Y点对应的溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】可逆反应 A(g)+3B(g)![]() 2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
2C(g)+2D(g),在不同情况下,测得有下列四个反应速率,其反应速率最快的是( )
A.υ(A)=0.2molL﹣1s﹣1B.υ(B)=0.6molL﹣1s﹣1
C.υ(C)=0.6molL﹣1s﹣1D.υ(D)=0.5molL﹣1s﹣1
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com