
【题目】在P+CuSO4+H2O→Cu3P+H3PO4+H2SO4(未配平)的反应中,7.5 mol CuSO4可氧化P的物质的量为________mol。生成1 mol Cu3P时,参加反应的P的物质的量为________mol。
【答案】1.5 2.2
【解析】
根据得失电子守恒配平方程式为11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,根据CuSO4和被氧化P的物质的量之间的关系式、Cu3P与参加反应的P的之间的关系式进行解答。
根据得失电子守恒配平方程式 :11P+15CuSO4+24H2O=5Cu3P+6H3PO4+15H2SO4,该反应中P既是氧化剂也是还原剂,同时Cu2+也是氧化剂,11mol的P中有5mol是氧化剂,6mol还原剂,7.5 mol CuSO4铜的化合价从+2变为+1 转移电子7.5mol,被 CuSO4氧化的p化合价从0价变成+5 转移电子也为7.5mol,所以7.5molCuSO4可氧化P的物质的量为![]() =1.5mol,生成1molCu3P 时,由方程式可得:11P~~5Cu3P,参加反应的P的物质的量=
=1.5mol,生成1molCu3P 时,由方程式可得:11P~~5Cu3P,参加反应的P的物质的量=![]() ×11mol= 2.2 mol。
×11mol= 2.2 mol。


 新题型全程检测期末冲刺100分系列答案
新题型全程检测期末冲刺100分系列答案科目:高中化学 来源: 题型:
【题目】已知某化学反应的平衡常数表达式为![]() ,在不同的温度下该反应的平衡常数值分别为:
,在不同的温度下该反应的平衡常数值分别为:
| 700 | 800 | 830 |
|
|
K |
|
|
|
|
|
下列有关叙述不正确的是![]()
![]()
A.该反应的化学方程式是![]()
B.上述反应的正反应是放热反应
C.如果在一定体积的密闭容器中加入![]() 和
和![]() 各
各![]() ,
,![]() 内温度升高到
内温度升高到![]() ,测得此时
,测得此时![]() 为
为![]() 时,推知此时反应为平衡状态
时,推知此时反应为平衡状态
D.如果平衡浓度符合关系式![]() ,判断此时的温度是
,判断此时的温度是![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1 和C2)、电源适配器和水瓶组装如图所示的装置。接通电源观察到:C1 周围产生细小气泡,C2 周围无明显现象;持续通电一段时间后,C2 周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。关于该实验的说法不正确的是

A.C1电极产生气泡原因:![]()
B.可以用两根铁钉代替铅笔芯完成实验
C.自制消毒剂的总反应为:NaCl+H2O ![]() NaClO+H2↑
NaClO+H2↑
D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】峨眉金顶摄身崖又称舍身崖,因常现佛光而得名。“佛光”因摄入身之影像于其中,遂称“摄身光”,为峨眉胜景之一。摄生崖下土壤中富含磷矿,所以在无月的黑夜可见到崖下荧光无数。
(1)“荧光”主要成分是PH3,其结构式为___________,下列有关PH3的说法错误的是___________。
a.PH3分子是极性分子
b.PH3分子稳定性低于NH3分子,因为N-H键键能高
c.一个PH3分子中,P原子核外有一对孤电子对
d.PH3沸点低于NH3沸点,因为P-H键键能低
(2)“荧光”产生的原理是Ca3P2在潮湿的空气中剧烈反应,写出该反应的化学方程式____________________。
(3)已知下列键能数据及P4(白磷)分子结构:
化学键 | P-P | H-H | P-H | 白磷分子结构 |
键能/(kJ·mol-1) | 213 | 436 | 322 |
|
则反应4PH3(g)![]() P4(g)+6H2(g) △H=___________ kJ· mol-1。
P4(g)+6H2(g) △H=___________ kJ· mol-1。
(4)某温度下,向容积为2L的密闭容器中通入2 mol PH3发生(3)中反应,5min后反应达平衡,测得此时H2的物质的量为1.5 mol,则用PH3表示的这段时间内的化学反应速率v(PH3)=__________;下列说法能表明该反应达到平衡状态的是___________。
A.混合气体的密度不变 B.6v(PH3)=4v(H2)
C.c(PH3):c(P4):c(H2)=4:1:6 D.混合气体的压强不变
(5)PH3有毒,白磷工厂常用Cu2+、Pd2+液相脱除PH3:PH3+2O2![]() H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:
H3PO4,其他条件相同时,溶解在溶液中O2的体积分数与PH3的净化效率与时间的关系如图所示,回答下列问题:

(I)由图可知,富氧有利于____________(选填“延长”或“缩短”)催化作用的持续时间。
(Ⅱ)随着反应进行,PH3的净化效率急剧降低的原因可能为_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化生产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1= + 41.1 kJmol-1 CO(g)+2H2(g)
H2O(g) +CO(g) ΔH1= + 41.1 kJmol-1 CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_________________________________。
(2)为提高CH3OH产率,理论上应采用的条件是_______________________(填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X 平衡转化率变化曲线。

① 反应物X 是_____(填“CO2”或“H2”)。
② 判断依据是_____。
(4)250℃、在体积为 2.0L 的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min 时反应达到平衡,测得 c(CH3OH) = 0.75 mol·L-1。
① 前 10min 的平均反应速率 v(H2)=_____mol·L-1·min-1。
② 经计算化学平衡常数 K =_____________________。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO 纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO 纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO 纳米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO 纳米片 | 12.0 | 70.6 |
(注:甲醇选择性是指的是转化的CO2中生成甲醇的百分含量)
根据上表所给数据,用CO2生产甲醇的最优选项为_____(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业上常用铁质容器盛装冷的浓硫酸。但某兴趣小组的同学发现将一定量的生铁与浓硫酸加热时,观察到固体能完全溶解,并产生大量气体。为此他们进行了如下探究实验。
[探究一]称取铁钉(碳素钢)6.0g放入15.0 mL浓硫酸中,加热,充分反应后得到溶液X,并收集到气体Y。
(1)(I)甲同学认为X中除Fe3+外还可能含有Fe2+。若要判断溶液X中是否含有Fe2+,可以选用___________。
a.KSCN溶液和氯水 b.K3[Fe(CN)6]溶液 c.浓氨水 d.酸性KMnO4溶液
(Ⅱ)乙同学将336 mL(标准状况)气体Y通入足量溴水中,发现溶液颜色变浅,试用化学方程式解释溴水颜色变浅的原因___________,然后向反应后的溶液中加入足量BaCl2溶液,经适当操作得干燥固体2.33 g。由此推知气体Y中SO2的体积分数为___________。(结果保留一位小数)。
[探究二]甲乙两同学认为气体Y中除SO2外,还可能含有H2和CO2。为此设计如图实验装置(图中夹持仪器省略)进行验证。

(2)简述该实验能产生少量H2的原因___________(用化学用语结合少量文字表述)。
(3)装置B中试剂的作用是___________,装置F的作用是___________。
(4)为了进一步确认CO2的存在,需在上述装置中添加M于___________(选填序号),M中所盛装的试剂可以是___________。
a.A~B之间 b.B~C之间 c.C~D之间 d.E~F之间
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电渗析法处理厨房垃圾发酵液,同时得到乳酸的原理如图所示(图中“HA”表示乳酸分子,乳酸的摩尔质量为90g/moL;“A-”表示乳酸根离子)。则下列说法不正确的是

A.交换膜 I为只允许阳离子透过的阳离子交换膜
B.阳极的电极反应式为:2H2O-4e-=O2↑+4H+
C.电解过程中采取一定的措施可控制阴极室的pH约为6~8,此时进入浓缩室的OH-可忽略不计。设200mL 20g/L乳酸溶液通电一段时间后阴极上产生的H2在标准状况下的体积约为6.72L,则该溶液浓度上升为155g/L(溶液体积变化忽略不计)
D.浓缩室内溶液经过电解后pH降低
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是( )
A.常温下,![]() 的氢氧化钠溶液中加入10mL
的氢氧化钠溶液中加入10mL ![]() 的HA,所得溶液
的HA,所得溶液![]()
B.![]() 时,
时,![]() 与
与![]() 的氯化铵溶液的pH前者大
的氯化铵溶液的pH前者大
C.室温时浓度均为![]() 的
的![]() 和
和![]() 的混合液,pH为10,则
的混合液,pH为10,则![]()
D.![]() 溶液:
溶液:![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,现有![]() 溶液,
溶液,![]() 已知含氮
已知含氮![]() 或含碳
或含碳![]() 各微粒的分布分数
各微粒的分布分数![]() 平衡时,各微粒浓度占总微粒浓度之和的分数
平衡时,各微粒浓度占总微粒浓度之和的分数![]() 与pH的关系如图所示。下列说法正确的是
与pH的关系如图所示。下列说法正确的是![]()
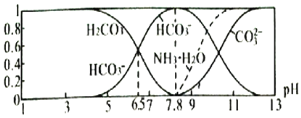
A.当![]() 时,溶液中存在下列关系:
时,溶液中存在下列关系:![]()
![]()
B.![]() 溶液中存在下列关系:
溶液中存在下列关系: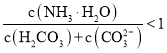
C.向![]() 的上述溶液中逐滴滴加氢氧化钠溶液时,
的上述溶液中逐滴滴加氢氧化钠溶液时,![]() 和
和![]() 浓度逐渐减小
浓度逐渐减小
D.分析可知,常温下水解平衡常数![]() 的数量级为
的数量级为![]()
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com