
【题目】室温时,向 20 mL 0.1 mol·L 1 的两种酸 HA、HB 中分别滴加0.1 mol·L 1 NaOH 溶液, 其 pH 变化分别对应下图中的 I、II。下列说法不正确的是( )
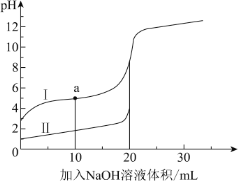
A.向 NaA 溶液中滴加 HB 可产生 HA
B.滴加 NaOH 溶液至 pH=7 时,两种溶液中 c(A-)=c(B-)
C.a 点,溶液中微粒浓度:c(A-) > c(Na+)
D.滴加 20 mL NaOH 溶液时,I 中 H2O 的电离程度大于 II 中
【答案】B
【解析】
A. 由图可知,0.1 mol·L1 HB溶液的pH小于等浓度的HA溶液,说明HB的酸性强于HA,由强酸制弱酸的原理可知,向NaA 溶液中滴加 HB 可产生 HA,A正确;
B. 由于HB的酸性强于HA,等浓度的HB溶液和HA溶液中,滴加NaOH溶液 pH=7 时,消耗NaOH溶液的体积不同,溶液中c(Na+)不同,则两种溶液中 c(A-)一定不等于c(B-),B错误;
C. a点为等浓度的HA和NaA混合液,溶液呈酸性,说明HA的电离大于NaA的水解,溶液中微粒浓度:c(A-)>c(Na+),C正确;
D. 滴加 20 mL NaOH 溶液时,等浓度的HB溶液和HA溶液均恰好完全反应生成NaB和NaA,由于HB的酸性强于HA,则NaA的水解程度大于NaB,Ⅰ中H2O的电离程度大于Ⅱ中,D正确;
故答案为B。


科目:高中化学 来源: 题型:
【题目】电导率是衡量电解质溶液导电能力大小的物理量,根据溶液电导率变化可以确定滴定反应的终点。在一定温度下,用0.1mol/LKOH溶液分别滴定体积均为20mL、浓度均为0.1mol/L的盐酸和醋酸溶液,滴定曲线如图所示。下列有关判断正确的是
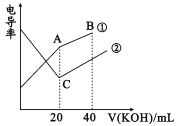
A. B点的溶液中有:c(K+)>c(OH-)>c(CH3COO-)>c(H+)
B. A点的溶液中有:c(CH3COO-)+c(OH-)-c(H+)=0.1mol/L
C. C点水电离的c(OH-)大于A点水电离的c(OH-)
D. A、B、C三点溶液均有Kw=c(H+)·c(OH-)=1.0×10-14
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤产生的重要污染物,主要成分有Al2O3、Fe2O3、Fe3O4和SiO2等物质。综合利用粉煤灰不仅能够防止环境污染,还能获得纳米Fe2O3等重要物质。
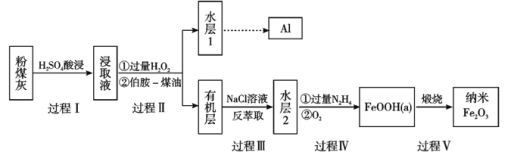
已知:
i)伯胺R-NH2能与Fe3+反应:3R-NH2+Fe3++SO42-+H2O![]() Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
Fe(NH2-R)3(OH)SO4+H+生成易溶于煤油的产物。
ii)Fe3+在水溶液中能与Cl-反应:Fe3++6Cl-![]() [FeCl6]3-,回答下列问题:
[FeCl6]3-,回答下列问题:
(1)过程I对煤粉灰进行酸浸过滤后,滤渣的主要成分是_____________。
(2)写出过程Ⅱ加入过量H2O2发生的离子方程式_____________。加入伯胺-煤油对浸取液进行分离,该操作的名称是_____________。
(3)从化学平衡角度解释过程Ⅲ利用NaCl溶液进行反萃取的原理_____________。
(4)过程Ⅳ中过量的N2H4将水层2中[FeCl6]3-转化为Fe2+,得到的Fe2+再被O2氧化为FeOOH,其中第一步的离子方程式为4[FeCl6]3-+5N2H4=4Fe2++N2+4N2H5++24Cl-,该反应中氧化剂与还原剂的物质的量之比为_______________。
(5)在常压用纳米Fe2O3电化学法合成氨的装置如图所示。已知电解液为熔融NaOH-KOH,纳米Fe2O3在阴极发生电极反应分两步进行:
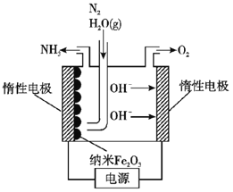
第一步:Fe2O3+3H2O+6e-=2Fe+6OH-;
第二步:2Fe+N2+3H2O=Fe2O3+2NH3。
则该电解池发生总反应的化学方程式为___________________________________,纳米Fe2O3在电解过程中所起的作用是___________________________________。
(6)某特殊的磁流体材料,其化学式通式为KxFeO2(其组成可理解为aK2O·bFeO·cFe2O3),若x平均值为1.3,则磁流体中Fe3+和Fe2+的质量之比为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氨和联氨(N2H4)是氮的两种常见化合物,在科学技术和生产中有重要的应用。
根据题意完成下列计算:
(1)联氨用亚硝酸氧化生成氮的另一种氢化物,该氢化物的相对分子质量为43.0,其中氮原子的质量分数为0.977,计算确定该氢化物的分子式___________。该氢化物受撞击则完全分解为氮气和氢气。4.30 g该氢化物受撞击后产生的气体在标准状况下的体积为___________L。
(2)联氨和四氧化二氮可用作火箭推进剂,联氨是燃料,四氧化二氮作氧化剂,反应产物是氮气和水。
由联氨和四氧化二氮组成的火箭推进剂完全反应生成72.0 kg水,计算推进剂中联氨的质量___________。
(3)氨的水溶液可用于吸收NO与NO2混合气体,反应方程式为6NO+ 4NH3=5N2+6H2O,6NO2+ 8NH3=7N2+12H2O;NO与NO2混合气体180 mol被8.90×103g氨水(质量分数0.300)完全吸收,产生156 mol氮气。吸收后氨水密度为0.980 g/cm3。计算:①该混合气体中NO与NO2的体积比____________。②吸收后氨水的物质的量浓度_______________(答案保留1位小数)。
(4)氨和二氧化碳反应可生成尿素CO(NH2)2。尿素在一定条件下会失去氨而缩合,如两分子尿素失去一分子氨形成二聚物:
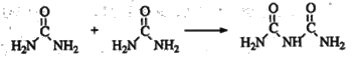 +NH3
+NH3
已知常压下120 mol CO(NH2)2在熔融状态发生缩合反应,失去80 mol NH3,生成二聚物(C2H5N3O2)和三聚物。测得缩合产物中二聚物的物质的量分数为0.60,推算缩合产物中各缩合物的物质的量之比__________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒温恒容的密闭容器中通入一定量的A、B,发生反应A(g)+2B(g)![]() 3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )
3C(g)。如图是A的反应速率v(A)随时间变化的示意图。下列说法正确的是( )

A.反应物A的浓度:a点小于b点
B.该反应的某种生成物可能对反应起催化作用
C.曲线上的c、d两点都表示达到平衡状态
D.A的平均反应速率:ab段大于bc段
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】新冠疫情期间某同学尝试在家自制含氯消毒剂。用两根铅笔芯(C1 和C2)、电源适配器和水瓶组装如图所示的装置。接通电源观察到:C1 周围产生细小气泡,C2 周围无明显现象;持续通电一段时间后,C2 周围产生细小气泡。此时停止通电,拔出电极,旋紧瓶塞,振荡摇匀,制备成功。关于该实验的说法不正确的是

A.C1电极产生气泡原因:![]()
B.可以用两根铁钉代替铅笔芯完成实验
C.自制消毒剂的总反应为:NaCl+H2O ![]() NaClO+H2↑
NaClO+H2↑
D.实验过程中要注意控制电压、开窗通风、导出氢气,确保安全
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,四种均为0.1molL﹣1的溶液,其pH如下表所示,下列关系不正确的是( )
序号 | ① | ② | ③ | ④ |
溶液 | NaCl | CH3COONH4 | NaHCO3 |
|
pH | 7.0 | 7.0 | 8.4 | 9.9 |
A.酸性:H2CO3>![]()
B.水电离产生的c(H+):①=②
C.溶液③中:c(HCO3-)+c(CO32-)+c(H2CO3)= 0.1molL﹣1
D.溶液④中:c(Na+)>c(![]() )>c(OH-)>c(H+)
)>c(OH-)>c(H+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年我国大力加强温室气体CO2催化氢化合成甲醇技术的工业化生产研究,实现可持续发展。
(1)已知:CO2(g)+H2(g)![]() H2O(g) +CO(g) ΔH1= + 41.1 kJmol-1 CO(g)+2H2(g)
H2O(g) +CO(g) ΔH1= + 41.1 kJmol-1 CO(g)+2H2(g)![]() CH3OH(g) ΔH2=-90.0 kJmol-1
CH3OH(g) ΔH2=-90.0 kJmol-1
写出CO2催化氢化合成甲醇的热化学方程式:_________________________________。
(2)为提高CH3OH产率,理论上应采用的条件是_______________________(填字母)。
A.高温高压 B.低温低压 C.高温低压 D.低温高压
(3)250℃、在恒容密闭容器中由CO2(g)催化氢化合成CH3OH(g),下图为不同投料比[n(H2)/n(CO2)]时某反应物X 平衡转化率变化曲线。

① 反应物X 是_____(填“CO2”或“H2”)。
② 判断依据是_____。
(4)250℃、在体积为 2.0L 的恒容密闭容器中加入6mol H2、2mol CO2和催化剂,10min 时反应达到平衡,测得 c(CH3OH) = 0.75 mol·L-1。
① 前 10min 的平均反应速率 v(H2)=_____mol·L-1·min-1。
② 经计算化学平衡常数 K =_____________________。
③ 催化剂和反应条件与反应物转化率和产物的选择性有高度相关。控制相同投料比和相同反应时间,四组实验数据如下:
实验编号 | 温度(K) | 催化剂 | CO2转化率(%) | 甲醇选择性(%) |
A | 543 | Cu/ZnO 纳米棒 | 12.3 | 42.3 |
B | 543 | Cu/ZnO 纳米片 | 11.9 | 72.7 |
C | 553 | Cu/ZnO 纳米棒 | 15.3 | 39.1 |
D | 553 | Cu/ZnO 纳米片 | 12.0 | 70.6 |
(注:甲醇选择性是指的是转化的CO2中生成甲醇的百分含量)
根据上表所给数据,用CO2生产甲醇的最优选项为_____(填字母)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将4 mol A气体和2 mol B气体在2 L的容器中混合并在一定条件下发生如下反应:2A(气)+B(气)![]() 2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
2C(气)。若经2 s(秒)后测得C的浓度为0.6 mol·L-1,现有下列几种说法:
①用物质A表示的反应平均速率为0.3 mol·L-1·s-1
②用物质B表示的反应的平均速率为0.6 mol·L-1·s-1
③2s时物质A的转化率为70%
④2s时物质B的浓度为0.7 mol·L-1
其中正确的是:
A.①③B.①④C.②③D.③④
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com