
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
【答案】C
【解析】
试题A、Ⅰ中由于稀硝酸有强的氧化性,与铁发生氧化还原反应,硝酸得到电子被还原变为NO,气体为无色,当遇到空气时,发生反应:2NO+O2=2NO2,气体变为红棕色的NO2,A正确;B、在Ⅱ中浓硝酸有强的氧化性,在室温下遇铁、铝会使金属表面氧化产生一层氧化物薄膜,对内层金属起保护作用,从而防止金属的进一步反应,即发生钝化现象,因此不能进一步反应,这恰好说明浓硝酸的氧化性比稀硝酸强,因此B正确;C、根据以上分析可知,C错误;D、Ⅲ中将金属铜放入浓硝酸中,Fe、Cu及浓硝酸构成原电池,由于铁在浓硝酸中发生发生钝化,因此铁为原电池的正极,铜为负极,失去电子被氧化变为Cu2+,在正极上溶液中的NO3-得到电子被还原为NO2气体,因此会看到有红棕色的气体产生。针对Ⅲ中现象,在Fe、Cu之间连接电流计,可根据电流计的指针偏转方向判断Fe是否被氧化,D正确,答案选C。


科目:高中化学 来源: 题型:
【题目】有关如图装置的叙述不正确的是 ( )
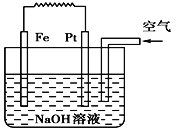
A. 这是电解NaOH溶液的装置
B. 该装置中Pt为正极,电极反应为O2+2H2O+4e- = 4OH-
C. 该装置中Fe为负极,电极反应为Fe+2OH-- 2e- = Fe(OH)2
D. 这是一个原电池装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某元素原子的结构示意图为 ,由此得到的结论不正确的是
,由此得到的结论不正确的是
A. 该原子有3个电子层B. 该元素属于金属元素
C. 该原子在化学反应中易得2个电子D. 该元素的最高正化合价为+6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某学习小组在实验室研究SO2与Ba(NO3)2溶液的反应。
实验:向盛有2mL 0.1mol/L Ba(NO3)2溶液的试管中,缓慢通入SO2气体,试管内有白色沉淀产生,液面上方略显浅棕色。
探究1:白色沉淀产生的原因。
(1)白色沉淀是_________(填化学式)。
(2)分析白色沉淀产生的原因,甲同学认为是NO3-氧化了SO2,乙同学认为是溶液中溶解的O2氧化了SO2。
①支持甲同学观点的实验证据是______________。
②乙同学通过下列实验证明了自己的推测正确,请完成实验方案:
实验操作 | 实验现象 |
向2mL___mol/L ___溶液(填化学式)中通入SO2 | ____________ |
探究2:在氧化SO2的过程中,NO3-和O2哪种微粒起到了主要作用。
实验操作 | 实验数据 |
向烧杯中加入煮沸了的0.1 mol/L的BaCl2溶液25mL,再加入25mL植物油,冷却至室温,用pH传感器测定溶液pH随时间(t)的变化曲线 |
图1:向BaCl2 (无氧)溶液中通入SO2 |
向烧杯中分别加入25mL 0.1 mol/L的BaCl2溶液、Ba(NO3)2溶液,通入SO2,用pH传感器分别测定溶液pH随时间(t)变化的曲线。 |
图2:分别向BaCl2、Ba(NO3)2溶液中通入SO2 |
(3)图1,在无氧条件下,向BaCl2溶液中持续通入SO2,溶液pH下降是因为_________(用方程式表示)。
(4)图2,BaCl2溶液中发生反应的离子方程式为___________。
(5)依据上述图像你得出的结论是_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】面对突如其来的新冠病毒,许多化学物质发挥了非常重要作用。下列说法正确的是
A.医用酒精灭活新冠肺炎病毒是利用其氧化性
B.N95 口罩所使用的聚丙烯材料属于合成纤维
C.为增强“84”消毒液的消毒效果,可滴加浓盐酸
D.我国研制的重组新冠疫苗无需冷藏保存
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 稀硝酸与Fe(OH)2溶液反应:Fe(OH)2+2H+= Fe2++2H2O
B. Cl2和水反应:Cl2+H2O=2H++Cl-+ClO-
C. 碳酸氢铵和足量的浓烧碱溶液混合:HCO3- +NH4++2OH-=NH3↑+2H2O+CO32-
D. SO2 与Ca(ClO)2溶液反应: SO2 +2ClO-+ Ca2+= CaSO3↓+2HClO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】为了测定乙醇的结构式,有人设计了用无水酒精与钠反应的实验装置和测定氢气体积的装置进行实验。可供选用的实验仪器如图所示。
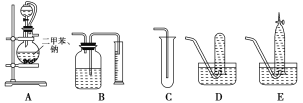
请回答以下问题:
(1)测量氢气体积的正确装置是________(填写编号)。
(2)装置中A部分的分液漏斗与蒸馏烧瓶之间连接的导管所起的作用是________(填写编号)。
A.防止无水酒精挥发
B.保证实验装置不漏气
C.使无水酒精容易滴下
(3)实验前预先将小块钠在二甲苯中熔化成小钠珠,冷却后倒入烧瓶中,其目的是
________________________________________________________________________。
(4)已知无水酒精的密度为0.789 g·cm-3,移取2.0 mL酒精,反应完全后(钠过量),收集390 mL气体。则乙醇分子中能被钠取代出的氢原子数为________,由此可确定乙醇的结构式为________________而不是____________________________________________________。
(5)实验所测定的结果偏高,可能引起的原因是________(填写编号)。
A.本实验在室温下进行
B.无水酒精中混有微量甲醇
C.无水酒精与钠的反应不够完全
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com