
【题目】某烃的分子式为C10H14,能使高锰酸钾酸性溶液褪色,分子结构中含两个相同的烷基,则此烃可能的结构有( )
A.2种B.3种C.4种D.5种
 名校课堂系列答案
名校课堂系列答案科目:高中化学 来源: 题型:
【题目】有机物A(C13H18O2)具有香味,可用作香皂、洗发香波的芳香剂。
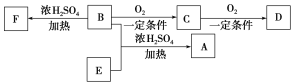
已知:①B属于芳香族化合物,分子式为C8H10O;
②D、E具有相同的官能团,E分子烃基上只有一种氢原子;
③F可以使溴的四氯化碳溶液褪色。
回答下列问题:
(1)B→F的反应类型是________,F的结构简式为____________。
(2)C、D分子所含的官能团的名称依次是________________、________________。
(3)E的同分异构体有多种,写出一种符合下列条件的有机物的结构简式:_______。
a.有两种含氧官能团;b.核磁共振氢谱显示有4个峰;c.能发生银镜反应,能与金属钠反应,但不能与氢氧化钠溶液反应。
(4)B和E反应生成A的化学方程式为____________________________________。
(5)D可以发生的反应有________(填序号)。
①酯化反应 ②消去反应
③加成反应 ④氧化反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W、Q、R六种元素,原子序数依次增大,X、Q能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,Y原子核外电子占据3个轨道,Z是形成化合物种类最多的元素,R基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同。
Ⅰ.Z2X2是有机合成工业的一种原料。
(1)将Z2X2通入[Cu(NH3)2]Cl溶液生成红棕色沉淀。Cu+基态核外电子排布式为_________________,比较NH3和[Cu(NH3)2]+中H-N-H键角的大小:NH3___[Cu(NH3)2]+(填“大于”或“小于”),并说明理由_________________
(2)Z2X2与XZW反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是_____________
。丙烯腈分子中碳原子轨道杂化类型是_____________
(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式____________________________________
Ⅱ.工业上用RZ2与X2Q反应生成Z2X2。
(4)RZ2中的Z22-与Q22+互为等电子体,Q22+的电子式可表示为__________。
(5)工业制Z2X2的原料(RZ2、X2Q)以及产物(Z2X2)的沸点从高到低排序,其顺序为___________(用化学式表示),其理由为_______________。
(6)RZ2晶体的晶胞结构与NaCl晶体的相似(如图所示),但RZ2晶体中含有的哑铃形Z22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm。RZ2晶体中,阳离子的配位数为____________, RZ2的密度___________g/cm3(用a、b表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某含锰矿物的主要成分有MnCO3、MnO2、FeCO3、SiO2、Al2O3等。已知FeCO3、MnCO3难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,主要流程如下:

(1)为提高含锰矿物浸出速率,可采取的措施有______________(至少写出两条)。
(2)设备1中反应后,滤液1里锰元素只以Mn2+的形式存在,且滤渣1中也无MnO2。设备1中发生氧化还原反应的离子方程式是______________________________________。
(3)设备2中加足量双氧水的作用是________________________。设计实验方案检验滤液2中是否存在Fe2+________________________。
(4)已知金属离子的氢氧化物开始沉淀和完全沉淀的pH如下表,加氨水调节溶液的pH等于6,滤渣2的主要成分为_____________ (填化学式)。
金属离子 | 开始沉淀的pH | 完全沉淀的pH |
Fe3+ | 1.8 | 3.2 |
Al3+ | 3.0 | 5.0 |
Fe2+ | 5.8 | 8.8 |
Mn2+ | 7.8 | 9.8 |
(5)设备4中加入过量氢氧化钠溶液,用离子方程式表示发生的反应______________。
(6)保持其他条件不变,在不同温度下对含锰矿物进行酸浸,锰浸出率随时间变化如图。酸浸的最佳温度与时间分别为________℃、______min。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量变化关系的描述中,说法不正确的是 ( )
A. 化学反应中,吸热反应不一定需要加热也能发生
B. 化学反应中一定有能量变化
C. 放热的反应,不必加热就能发生反应
D. 热化学反应方程式中,热效应数值与反应物的物质的量多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2 ![]() CO+H2O的平衡常数表达式为K==
CO+H2O的平衡常数表达式为K==![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在恒容绝热密闭容器中,对于反应A(g)+B(g) ![]() 3C(g)(正反应为放热反应),下述为平衡状态标志的是)
3C(g)(正反应为放热反应),下述为平衡状态标志的是)
①单位时间内A、B生成C的分子数与C分解的分子数相等 ②外界条件不变时,A、B、C浓度不随时间变化 ③体系温度不再变化 ④体系的压强不再变化 ⑤体系的分子总数不再变化
A. ①② B. ①②③ C. ①②③④ D. ①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com