
【题目】原子序数小于36的X、Y、Z、W、Q、R六种元素,原子序数依次增大,X、Q能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,Y原子核外电子占据3个轨道,Z是形成化合物种类最多的元素,R基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同。
Ⅰ.Z2X2是有机合成工业的一种原料。
(1)将Z2X2通入[Cu(NH3)2]Cl溶液生成红棕色沉淀。Cu+基态核外电子排布式为_________________,比较NH3和[Cu(NH3)2]+中H-N-H键角的大小:NH3___[Cu(NH3)2]+(填“大于”或“小于”),并说明理由_________________
(2)Z2X2与XZW反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是_____________
。丙烯腈分子中碳原子轨道杂化类型是_____________
(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式____________________________________
Ⅱ.工业上用RZ2与X2Q反应生成Z2X2。
(4)RZ2中的Z22-与Q22+互为等电子体,Q22+的电子式可表示为__________。
(5)工业制Z2X2的原料(RZ2、X2Q)以及产物(Z2X2)的沸点从高到低排序,其顺序为___________(用化学式表示),其理由为_______________。
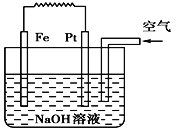
(6)RZ2晶体的晶胞结构与NaCl晶体的相似(如图所示),但RZ2晶体中含有的哑铃形Z22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm。RZ2晶体中,阳离子的配位数为____________, RZ2的密度___________g/cm3(用a、b表示)。

【答案】1s22s22p63s23p63d10或[Ar] 3d10小于NH3与Cu+形成配位键,N-H键斥力减小,键角增大或NH3分子内存在孤电子对,孤电子对与共用电子对之间的斥力更大,所以NH3的键角更小sp杂化、sp2杂化B(OH)3+ H2O ![]() [B(OH)4]-+H+
[B(OH)4]-+H+![]() CaC2 H2O C2H2CaC2、H2O、C2H2分别属于离子晶体、分子晶体、分子晶体,离子晶体的沸点高于分子晶体;H2O分子间存在氢键,作用力较大,故其沸点高于C2H2464×4/(a2b×10-21NA)(或者NA用6.02×1023表示)
CaC2 H2O C2H2CaC2、H2O、C2H2分别属于离子晶体、分子晶体、分子晶体,离子晶体的沸点高于分子晶体;H2O分子间存在氢键,作用力较大,故其沸点高于C2H2464×4/(a2b×10-21NA)(或者NA用6.02×1023表示)
【解析】
原子序数小于36的X、Y、Z、W、Q、R五种元素,原子序数依次增大,X、Q能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,则X是H元素、Q是O元素,甲是H2O、乙是H2O2;Y原子核外电子占据3个轨道,则Y为B;Z是形成化合物种类最多的元素,为C元素;R基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同,则E是Ca元素。
(1)Cu是29号元素,其原子核外有29个电子,Cu原子失去最外层1个电子生成Cu+,根据构造原理书写Cu+核外电子排布式为1s22s22p63s23p63d10或[Ar] 3d10;NH3与Cu+形成配位键,N-H键斥力减小,键角增大或NH3分子内存在孤电子对,孤电子对与共用电子对之间的斥力更大,所以NH3的键角更小;
(2)Z2X2是C2H2,Z2X2与XZW反应可得丙烯腈![]() 则 XZW为HCN,HCN分子中C原子价层电子对个数是2且不含孤电子对,所以C原子杂化类型sp杂化,丙烯腈分子中亚甲基C原子价层电子对个数是3,杂化类型是sp2杂化,剩余两个C原子价层电子对个数是2,所以C原子杂化类型sp杂化;
则 XZW为HCN,HCN分子中C原子价层电子对个数是2且不含孤电子对,所以C原子杂化类型sp杂化,丙烯腈分子中亚甲基C原子价层电子对个数是3,杂化类型是sp2杂化,剩余两个C原子价层电子对个数是2,所以C原子杂化类型sp杂化;
(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,则Y(OH)3为B(OH)3
电离方程式为:B(OH)3+ H2O ![]() [B(OH)4]-+H+;
[B(OH)4]-+H+;
(4)CaC2中C22-与O22+互为等电子体,等电子体原子个数相同、电子数相同、结构相似,所以O22+的电子式为![]() ;
;
(5)Z2X2为C2H2、X2Q 为H2O、RZ2 为CaC2,CaC2、H2O、C2H2分别属于离子晶体、分子晶体、分子晶体,离子晶体的沸点高于分子晶体;H2O分子间存在氢键,作用力较大,故其沸点高于C2H2 ,故沸点由高到低的顺序为:CaC2 >H2O >C2H2;
(6)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm, CaC2晶体中,阳离子的配位数为4,该晶胞中Ca2+个数![]() 、C22-个数
、C22-个数![]() ,其密度
,其密度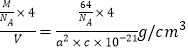 。
。


 教学练新同步练习系列答案
教学练新同步练习系列答案 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案科目:高中化学 来源: 题型:
【题目】表中a、b、c表示相应仪器中加入的试剂,可用如图所示装置制取、净化、收集的气体是 ( )
编号 | 气体 | a | b | c |
A | NH3 | 浓氨水 | 生石灰 | 碱石灰 |
B | SO2 | 70%浓H2SO4 | Na2SO3固体 | 98%浓H2SO4 |
C | NO | 稀HNO3 | 铜屑 | H2O |
D | NO2 | 浓HNO3 | 铜屑 | NaOH溶液 |
A. A B. B C. C D. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按如图所示装置进行实验,将液体A逐滴加入到固体B中,下列叙述不正确的是
A. 若A为浓硫酸,B为K2SO3,C中盛品红溶液,则C中溶液褪色
B. 若A为浓氨水,B为生石灰,C中盛AlCl3溶液,则C中先变浑浊后澄清
C. 若A为醋酸,B为CaCO3,C中盛Na2SiO3溶液,则C中溶液中变浑浊
D. 若A为双氧水,B为MnO2,C中盛Na2S溶液,则C中溶液中变浑浊
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用周期表中同主族元素的相似性,可预测元素的性质。
(1)白磷的分子式为P4,其结构如图甲所示。科学家目前合成了N4分子,N原子的杂化轨道类型是______;N4分解后能产生N2并释放出大量能量,推测其用途为____________。
(2)N、P、As原子的第一电离能由大到小的顺序为___________。
(3)比较酸性:HNO3_______HNO2(填“强于”或“弱于”),原因是___________________
(4)立方氮化硼晶体的结构如图乙所示。该晶体中,B原子填充在N原子的______(填空间构型名称)空隙中,且占据此类空隙的比例为________(填百分数)。


(5)钠钾合金属于金属晶体,其某种合金的晶胞结构如图所示。合金的化学式为____________;晶胞中K 原子的配位数为______;已知金属原子半径r(Na)=186pm、r(K)=227pm,计算晶体的空间利用率 _______________(列出计算式,不需要计算出结果)。
 。
。
查看答案和解析>>
科目:高中化学 来源: 题型:
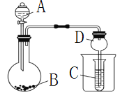
【题目】硼、镁及其化合物在工农业生产中应用广泛。
已知:硼镁矿主要成分为Mg2B2O5H2O,硼砂的化学式为Na2B4O710H2O。利用硼镁矿制取金属镁及粗硼的工艺流程为:
回答下列有关问题:
(1)硼砂中B的化合价为________________,溶于热水后,常用H2SO4调pH为2~3制取H3BO3,反应的离子方程式为________________________________________________________________。X为H3BO3晶体加热脱水的产物,其与Mg制取粗硼的化学方程式为_______________________________________________________________。
(2)MgCl2·7H2O需要在HCl氛围中加热,其目的是______________________________________________________________。若用惰性电极电解MgCl2溶液,其总反应离子方程式为____________________________________________________________。
(3)镁-H2O2酸性燃料电池的反应机理为Mg+H2O2+2H+═Mg2++2H2O,则正极反应式为____________________________________________________。
(4)制得的粗硼在一定条件下生成BI3,BI3加热分解可以得到纯净的单质硼。现将0.020g粗硼制成的BI3完全分解,生成的I2用0.30mol·L-1Na2S2O3溶液滴定至终点,并选用指示剂,达到滴定终点的现象是_________________________________________。消耗Na2S2O3溶液18.00mL。该粗硼样品的纯度为__________________。(提示:I2+2S2O32-=2I-+S4O62-)
查看答案和解析>>
科目:高中化学 来源: 题型:
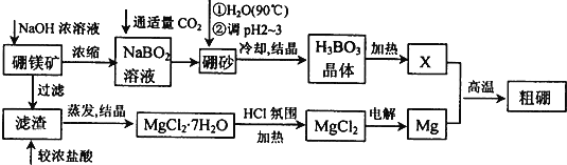
【题目】有关如图装置的叙述不正确的是 ( )
A. 这是电解NaOH溶液的装置
B. 该装置中Pt为正极,电极反应为O2+2H2O+4e- = 4OH-
C. 该装置中Fe为负极,电极反应为Fe+2OH-- 2e- = Fe(OH)2
D. 这是一个原电池装置
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列离子方程式正确的是( )
A. 稀硝酸与Fe(OH)2溶液反应:Fe(OH)2+2H+= Fe2++2H2O
B. Cl2和水反应:Cl2+H2O=2H++Cl-+ClO-
C. 碳酸氢铵和足量的浓烧碱溶液混合:HCO3- +NH4++2OH-=NH3↑+2H2O+CO32-
D. SO2 与Ca(ClO)2溶液反应: SO2 +2ClO-+ Ca2+= CaSO3↓+2HClO
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com