
【题目】有关如图装置的叙述不正确的是 ( )
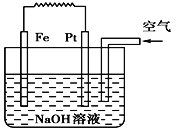
A. 这是电解NaOH溶液的装置
B. 该装置中Pt为正极,电极反应为O2+2H2O+4e- = 4OH-
C. 该装置中Fe为负极,电极反应为Fe+2OH-- 2e- = Fe(OH)2
D. 这是一个原电池装置
【答案】A
【解析】
该原电池中,铁发生吸氧腐蚀,铁易失电子作负极、铂丝作正极,负极上电极反应式为Fe-2e-+2OH-═Fe(OH)2,正极电极反应式为O2+2H2O+4e-═4OH-,再结合物质性质分析解答。
A、该装置中铁发生吸氧腐蚀,是将化学能转化为电能,为原电池,选项A不正确;B、该装置中Pt作正极,正极上氧气得电子发生还原反应,电极反应式为O2+2H2O+4e-═4OH-,选项B正确;C、该装置中Fe为负极,在NaOH溶液中电极反应为:Fe-2e-+2OH-═Fe(OH)2,选项C正确;D、该装置中铁发生吸氧腐蚀,是将化学能转化为电能,为原电池,选项D正确;答案选A。


 夺冠训练单元期末冲刺100分系列答案
夺冠训练单元期末冲刺100分系列答案 新思维小冠军100分作业本系列答案
新思维小冠军100分作业本系列答案 名师指导一卷通系列答案
名师指导一卷通系列答案科目:高中化学 来源: 题型:
【题目】焦亚硫酸钠(Na2S2O5)是常用的脱氧剂,其制备方法是向Na2CO3溶液中通入SO2,生成NaHSO3和CO2,一定条件下NaHSO3转化为Na2S2O5。完成下列填空:
(1)碳原子的原子结构示意图是_____________;CO2中所含共价键的类型_____________。
(2)从原子结构的角度,解释氧元素的非金属性比硫元素强的原因。_______________。
(3)SO2 与Na2CO3溶液反应生成NaHSO3和CO2,其化学方程式为_______________________,证明NaHSO3溶液中HSO3-的电离程度大于水解程度,可采用的实验方法是_________________。
(4)Na2S2O5作脱氧剂时的反应原理为Na2S2O5+O2+ H2O→Na2SO4+H2SO4,该反应中,氧化产物是______;若反应中转移了0.04mol的电子,有________g Na2S2O5参加反应。
(5)连二亚硫酸钠Na2S2O4俗称保险粉,广泛用于纺织工业的还原性染色、清洗、印花、脱色以及织物的漂白等。Na2S2O4属于强还原剂,暴露于空气中易被氧气氧化。Na2S2O4遇KMnO4酸性溶液发生反应:5Na2S2O4+6KMnO4+4H2SO4=5Na2SO4+3K2SO4+6MnSO4+4H2O。
为了测定保险粉纯度。称取5.0g Na2S2O4样品溶于冷水中,配成100mL溶液,取出10mL 该溶液于锥形瓶中,用0.1000mol/L的KMnO4 溶液滴定。重复上述操作2 次,平均消耗KMnO4 溶液21.00mL。则该样品中Na2S2O4的质量分数为__________(杂质不参与反应)。(保留至0.1%)
(6)“钢是虎,钒是翼,钢含钒犹如虎添翼”,钒是“现代工业的味精”。钒对稀酸是稳定的,但室温下能溶解于浓硝酸中生成VO2+。请写出金属钒与浓硝酸反应的离子方程式:_______________________________________。
(7)V2O5是两性氧化物,与强碱反应生成钒酸盐(阴离子为VO43-),溶于强酸生成含钒氧离子(VO2+)的盐。请写出V2O5分别与烧碱溶液和稀硫酸反应生成的盐的化学式:__________、_________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】原子序数小于36的X、Y、Z、W、Q、R六种元素,原子序数依次增大,X、Q能形成两种液态化合物甲和乙,原子个数比分别为2∶1和1∶1,Y原子核外电子占据3个轨道,Z是形成化合物种类最多的元素,R基态原子的第一能层与第四能层填充的电子数相同,第二能层与第三能层填充的电子数相同。
Ⅰ.Z2X2是有机合成工业的一种原料。
(1)将Z2X2通入[Cu(NH3)2]Cl溶液生成红棕色沉淀。Cu+基态核外电子排布式为_________________,比较NH3和[Cu(NH3)2]+中H-N-H键角的大小:NH3___[Cu(NH3)2]+(填“大于”或“小于”),并说明理由_________________
(2)Z2X2与XZW反应可得丙烯腈![]() 。丙烯腈分子中碳原子轨道杂化类型是_____________
。丙烯腈分子中碳原子轨道杂化类型是_____________
(3)Y(OH)3是一元弱酸,其中Y原子因缺电子而易形成配位键,写出Y(OH)3在水溶液中的电离方程式____________________________________
Ⅱ.工业上用RZ2与X2Q反应生成Z2X2。
(4)RZ2中的Z22-与Q22+互为等电子体,Q22+的电子式可表示为__________。
(5)工业制Z2X2的原料(RZ2、X2Q)以及产物(Z2X2)的沸点从高到低排序,其顺序为___________(用化学式表示),其理由为_______________。
(6)RZ2晶体的晶胞结构与NaCl晶体的相似(如图所示),但RZ2晶体中含有的哑铃形Z22-的存在,使晶胞沿一个方向拉长,晶胞的边长分别为a nm、a nm、b nm。RZ2晶体中,阳离子的配位数为____________, RZ2的密度___________g/cm3(用a、b表示)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于化学反应与能量变化关系的描述中,说法不正确的是 ( )
A. 化学反应中,吸热反应不一定需要加热也能发生
B. 化学反应中一定有能量变化
C. 放热的反应,不必加热就能发生反应
D. 热化学反应方程式中,热效应数值与反应物的物质的量多少有关
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关平衡常数的说法中,正确的是 ( )
A. 改变条件,反应物的转化率增大,平衡常数也一定增大
B. 反应2NO2(g)![]() N2O4(g) △H <0,升高温度该反应平衡常数增大
N2O4(g) △H <0,升高温度该反应平衡常数增大
C. 对于给定可逆反应,温度一定时,其正、逆反应的平衡常数相等
D. CO2+H2 ![]() CO+H2O的平衡常数表达式为K==
CO+H2O的平衡常数表达式为K==![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】自然界中的许多植物中含有醛,其中有些具有特殊香味,可作为植物香料使用,例如桂皮含肉桂醛(![]() ),杏仁含苯甲醛(
),杏仁含苯甲醛(![]() )。下列说法错误的是
)。下列说法错误的是
A. 肉桂醛能发生加成反应、取代反应和加聚反应
B. 可用新制氢氧化铜悬浊液检验肉桂醛分子中的含氧官能团
C. 肉桂醛和苯甲醛互为同系物
D. 苯甲醛分子中所有原子可能位于同一平面内
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在通风橱中进行下列实验:
步骤 |
|
| |
现象 | Fe表面产生大量无色气泡,液面上方变为红棕色 | Fe表面产生少量红棕色气泡后,迅速停止 | Fe、Cu接触后,其表面均产生红棕色气泡 |
下列说法不正确的是
A. I中气体由无色变红棕色的化学方程式:2NO+O2=2NO2
B. II中的现象说明Fe表面形成致密的氧化层,阻止Fe进一步反应
C. 对比I、II中现象,说明稀HNO3的氧化性强于浓HNO3
D. 针对Ⅲ中现象,在Fe、Cu之间连接电流计,可判断Fe是否被氧化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D、E、F、G均为短周期元素,原子序数依次递增。A元素原子核内无中子,B元素原子最外层电子数是次外层电子数的2倍,D是地壳中含量最多的元素,E的化合物焰色反应是黄色,F与G位置相邻,G是同周期元素中原子半径最小的元素。
请用化学用语回答:
(1)D的简单阴离子的结构示意图是___________。
(2)用电子式表示E2F的形成过程____________。
(3)E、F、G三种元素所形成的简单离子,半径由大到小的顺序是_________>_________>_________。
(4)下列实验操作对应的实验现象中,不正确的是_________(填字母)。
选项 | 实验操作 | 实验现象 |
a | 将E单质投入到CuSO4溶液中 | 生成大量红色固体 |
b | 向AlCl3溶液中通入过量C的气态氢化物 | 先生成白色沉淀,然后沉淀溶解 |
c | 将G的单质通入到NaBr溶液中充分反应后,加入四氯化碳,振荡,静置 | 下层溶液变为橙色 |
d | 将B的最高价氧化物通入到Na2SiO3溶液中 | 生成白色沉淀 |
(5)写出A与B形成的10电子分子的化学式_________,该物质与G的单质在光照下反应,一段时间后,下列装置示意图中能正确反映实验现象的是_________(填字母)。

(6)在Fe和Cu的混合物中,加入一定量的C的最高价氧化物对应的水化物的稀溶液,充分反应后剩余金属m1 g,再向其中加入一定量的稀硫酸,充分反应后剩余金属m2 g。下列说法正确的是_________(填字母)。
a m1大于m2 b m1等于m2
c 剩余溶液中一定有Fe3+ d 剩余金属中一定有Cu
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以甲醇为燃料的新型电池,其成本大大低于以氢气为燃料的传统燃料电池,目前得到广泛的研究,如图是目前研究较多的一类固体氧化物燃料电池工作原理示意图。回答下列问题:

(1)B极上的电极反应式为___________________________。
(2)若用该燃料电池做电源,用石墨做电极电解硫酸铜溶液,则电解时阳极的反应式为_______________________________________,当阳极收集到11.2L(标准状况)气体时,消耗甲醇的质量为__________克(保留两位有效数字),若要使溶液复原,可向电解后的溶液中加入的物质有 ___________。
(3)目前已开发出用电解法制取ClO2的新工艺。
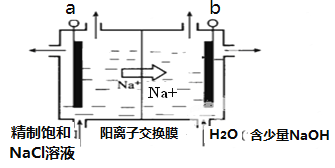
①上图示意用石墨做电极,在一定条件下电解饱和食盐水制取ClO2。若用上述甲醇燃料电池进行电解,则电解池的电极a接甲醇燃料电池的________极(填A或B),写出阳极产生ClO2的电极反应式:__________。
②电解一段时间,当阴极产生的气体体积为112 mL(标准状况)时,停止电解。通过阳离子交换膜的阳离子的物质的量为_________mol。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com